
【题目】用下列装置验证SO2的某些性质(加热及夹持装置略去)。
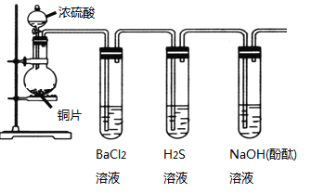
(1)装有浓硫酸的仪器名称是____________。
(2)铜与浓硫酸反应的化学方程式是____________________________________。
(3)能验证SO2具有氧化性的实验现象是_____________________________。
(4)装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是______,_____。
(5)写出SO2显示还原性并生成白色沉淀的总的离子方程式____________________________。
(6)能验证SO2具有酸性氧化物的通性的实验现象_____。若通入过量的SO2,则其总反应的离子反应方程式是_________。
【答案】分液漏斗 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ H2S溶液中产生淡黄色沉淀 BaSO3 BaSO4 Ba2++SO2+Cl2+2H2O=4H++BaSO4↓+2Cl- 滴有酚酞的氢氧化钠溶液由红色变为无色 SO2+OH-→HSO3-
CuSO4+2H2O+SO2↑ H2S溶液中产生淡黄色沉淀 BaSO3 BaSO4 Ba2++SO2+Cl2+2H2O=4H++BaSO4↓+2Cl- 滴有酚酞的氢氧化钠溶液由红色变为无色 SO2+OH-→HSO3-
【解析】
根据实验装置图可知,圆底烧瓶中用铜与浓硫酸在加热的条件下生成硫酸铜和二氧化硫,由于二氧化硫溶于水生成的亚硫酸是弱酸,所以通入到氯化钡溶液中,不能产生沉淀;将生成的二氧化硫通入到硫化氢溶液中,二氧化硫有氧化性,能与硫化氢反应生成硫单质,所以可以看到有浅黄色浑浊出现;因为二氧化硫为酸性氧化物能与氢氧化钠反应,所以二氧化硫通过有酚酞的氢氧化钠溶液时,溶液的红色将会褪去。
(1)装有浓硫酸的仪器名称是分液漏斗,答案应为分液漏斗;
(2)该实验利用铜与浓硫酸在加热的条件下反应制备二氧化硫,其化学方程式为Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(3)要想验证SO2具有氧化性,需要用还原剂与二氧化硫反应。在本实验中,具有还原性的试剂为H2S溶液,其与SO2反应的原理为SO2+2H2S=3S↓+2H2O,故该实验的现象为产生淡黄色沉淀;
(4)装有BaCl2溶液的试管中无任何现象,将其分成两份,如果一份加入氨水,与二氧化硫反应生成亚硫酸铵,亚硫酸铵能与氯化钡反应生成亚硫酸钡沉淀,化学式为BaSO3;另一份中滴加氯水,氯水会将亚硫酸氧化成硫酸,与氯化钡会产生硫酸钡沉淀,化学式为BaSO4。答案为:BaSO3 、BaSO4
(5)在上述两个反应中,加入的氯水具有氧化性,与二氧化硫反应时可使SO2显示还原性并生成白色沉淀。该反应的总离子方程式为Ba2++SO2+Cl2+2H2O=4H++BaSO4↓+2Cl-。
(6)酸性氧化物的通性是能与碱反应生成盐和水,因此能验证SO2具有酸性氧化物的通性的实验现象为滴有酚酞的氢氧化钠溶液由红色变为无色。如若向氢氧化钠溶液中通入过量的SO2,则其总反应的离子反应方程式应写为SO2+OH-→HSO3-。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】哈大齐高铁的通车,标志我国高寒地区高铁技术领先世界,车厢大部分采用铝合金材料制造,这是因为铝合金
A. 质量轻,强度大,抗腐蚀能力比较强 B. 具有比较活泼的化学性质
C. 各种成分在自然界中含量丰富,容易获取 D. 比纯铝熔点高,耐高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、J是元素周期表前四周期中的五种常见元素![]() 其相关信息如下表:
其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | M层上有2对成对电子 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
![]() 元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
![]() 元素Y位于元素周期表第 ______ 周期第 ______ 族;
元素Y位于元素周期表第 ______ 周期第 ______ 族;
![]() 元素Z的原子最外层共有 ______ 种不同运动状态的电子;
元素Z的原子最外层共有 ______ 种不同运动状态的电子;
![]() 的基态原子核外价电子排布图是 ______ ;
的基态原子核外价电子排布图是 ______ ;
![]() 的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是

A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是

A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙是人体必需的常量元素,成年人每天需要800mg的钙,下列补钙的途径正确的是
A. 经常吃水果、蔬菜B. 经常饮用钙离子含量高的硬水
C. 经常饮用牛奶、豆奶D. 大量补充维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D,回答下列问题:
D,回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则
①简述检验该盐中阳离子的方法:_____________________________________;
②写出实验室制取A的化学方程式:______________________________________;
③写出由A生成B的化学方程式:______________________________________;
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因:____________________。
(2)若A与B反应能生成一种淡黄色固体单质,写出该反应的化学方程式: ________________________________________________________________。
(3)若A是金属单质,C是一种淡黄色固体,写出C生成D的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
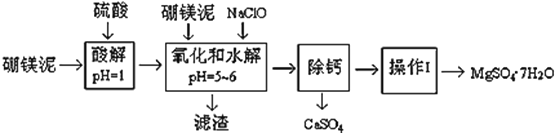
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________,___________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com