
【题目】钙是人体必需的常量元素,成年人每天需要800mg的钙,下列补钙的途径正确的是
A. 经常吃水果、蔬菜B. 经常饮用钙离子含量高的硬水
C. 经常饮用牛奶、豆奶D. 大量补充维生素C
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列叙述错误的是
表示阿伏加德罗常数的值,下列叙述错误的是![]()
![]()
A. 标准状况下,![]() 氯气与足量水反应,转移电子数目为
氯气与足量水反应,转移电子数目为![]()
B. ![]() 中含有的质子数为
中含有的质子数为![]()
C. 12g金刚石中含有的共价键数为![]()
D. 标准状况下,![]() 氟化氢中含有氟原子的数目大于
氟化氢中含有氟原子的数目大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.由同一种元素组成的物质一定是纯净物
B.两种元素只能组成一种化合物
C.一种元素在同一种化合物中只能显示一种价态
D.金属元素在化合物中只显示正化合价,而非金属元素在化合物中可以显示正化合价或负化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置验证SO2的某些性质(加热及夹持装置略去)。
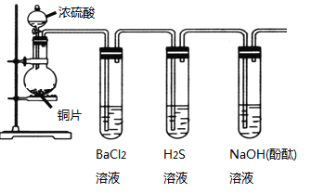
(1)装有浓硫酸的仪器名称是____________。
(2)铜与浓硫酸反应的化学方程式是____________________________________。
(3)能验证SO2具有氧化性的实验现象是_____________________________。
(4)装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是______,_____。
(5)写出SO2显示还原性并生成白色沉淀的总的离子方程式____________________________。
(6)能验证SO2具有酸性氧化物的通性的实验现象_____。若通入过量的SO2,则其总反应的离子反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将等体积的NO和 NO2充入试管,并将试管倒立于水槽中,充分反应后剩余气体的体积缩小为原体积的 ( )
A.1/2B.1/3C.3/8D.2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
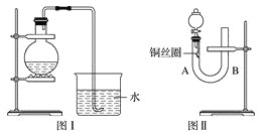
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,由钴氧化物负载的锰氧化物纳米粒子催化剂对某些反应具有高活性,应用前景良好。回答下列问题:
(1)Mn基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是________;Mn与Co相比,基态原子核外未成对电子数较少的是_______。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)沸点相比较:
①甲醇____H2O(填写“>”“<”或“=”);原因是_____________________________;
②CO2____H2(填写“>”“<”或“=”);原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了π键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为αnm,则r(O2-)为________ nm (用含α的算式表示,不必运算化简,下同)。MnO也属于NaCl型结构,晶胞参数为αˊnm,则r(Mn2+)为________nm(用含α、αˊ的算式表示)。
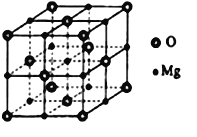
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:
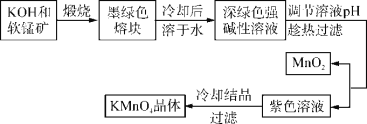
已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO![]() )在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO
)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO![]() 会发生自身氧化还原反应,生成MnO
会发生自身氧化还原反应,生成MnO![]() 和MnO2。
和MnO2。
回答下列问题:
(1)KOH的电子式为____________。
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为____________。
(3)趁热过滤的目的是_____________________________________________。
(4)已知20 ℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1 g、34 g、217 g,则从理论上分析,选用下列酸中________(填标号),得到的高锰酸钾晶体纯度更高。
A.稀硫酸 B.浓盐酸 C.醋酸 D.稀盐酸
(5)产品中KMnO4的定量
①配制浓度为0.1250 mg· mL-1的KMnO4标准溶液100 mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。

③称取KMnO4样品(不含K2MnO4)0.1250 g按步骤①配得产品溶液1000 mL,取10 mL稀释至100 mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为________。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com