
【题目】研究发现,由钴氧化物负载的锰氧化物纳米粒子催化剂对某些反应具有高活性,应用前景良好。回答下列问题:
(1)Mn基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是________;Mn与Co相比,基态原子核外未成对电子数较少的是_______。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)沸点相比较:
①甲醇____H2O(填写“>”“<”或“=”);原因是_____________________________;
②CO2____H2(填写“>”“<”或“=”);原因是________________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了π键外,还存在________。
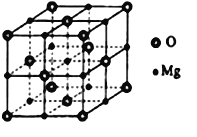
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为αnm,则r(O2-)为________ nm (用含α的算式表示,不必运算化简,下同)。MnO也属于NaCl型结构,晶胞参数为αˊnm,则r(Mn2+)为________nm(用含α、αˊ的算式表示)。
【答案】1s22s22p63s23p63d54s2 或[Ar]3d54s2 OCospsp3<H2O与CH3OH均为极性分子,H2O中氢键比甲醇多>CO2与H2均为非极性分子,CO2分子量较大、范德华力较大离子键和σ键![]()
![]()
【解析】
(1)根据构造原理写基态Mn原子的核外电子排布式;第一电离能:Mn<O;基态Mn原子核外未成对电子数为5,基态Co原子核外未成对电子数为3。
(2)CO2中C原子为sp杂化,CH3OH中C原子为sp3杂化。
(3)①CH3OH和H2O都是极性分子,H2O中氢键比CH3OH多,沸点:CH3OH<H2O;
②CO2和H2都是非极性分子,CO2的相对分子质量>H2的相对分子质量,CO2的范德华力>H2的范德华力,沸点:CO2>H2。
(4)Mn(NO3)2中Mn2+与NO3-之间存在离子键,NO3-内N原子和O原子间存在σ键和π键。
(5)MgO晶胞中阴离子采用面心立方最密堆积,4r(O2-)=![]() αnm;MnO也属于NaCl型,根据“MnO的晶胞参数=2r(Mn2+)+2r(O2-)”解得r(Mn2+)。
αnm;MnO也属于NaCl型,根据“MnO的晶胞参数=2r(Mn2+)+2r(O2-)”解得r(Mn2+)。
(1)Mn的原子序数为25,Mn原子核外有25个电子,根据构造原理,基态Mn原子的核外电子排布式为1s22s22p63s23p63d54s2(或[Ar] 3d54s2);Mn为金属元素易失去电子,O为非金属元素,第一电离能:Mn<O,第一电离能较大的是O;基态Mn原子价电子排布式为3d54s2,基态Mn原子核外未成对电子数为5,基态Co原子价电子排布式为3d74s2,基态Co原子核外未成对电子数为3,基态原子核外未成对电子数较少的是Co。
(2)CO2中中心原子C的价层电子对数为![]() ×(4-2×2)+2=2,CO2中C原子为sp杂化;CH3OH中C原子形成4个σ键,C上没有孤电子对,C的价层电子对数为4,CH3OH中C原子为sp3杂化。
×(4-2×2)+2=2,CO2中C原子为sp杂化;CH3OH中C原子形成4个σ键,C上没有孤电子对,C的价层电子对数为4,CH3OH中C原子为sp3杂化。
(3)①CH3OH和H2O都是极性分子,H2O中氢键比CH3OH多(1molH2O中含2mol氢键,1molCH3OH中含1mol氢键),沸点:CH3OH<H2O;
②CO2和H2都是非极性分子,CO2的相对分子质量>H2的相对分子质量,CO2的范德华力>H2的范德华力,沸点:CO2>H2。
(4)Mn(NO3)2中Mn2+与NO3-之间存在离子键,NO3-内N原子与O原子间除了存在π键外还存在3个σ键,Mn(NO3)2中除了π键外,还有离子键和σ键。
(5)MgO晶胞中阴离子采用面心立方最密堆积,则4r(O2-)=![]() αnm,r(O2-)=
αnm,r(O2-)=![]() nm;MnO也属于NaCl型,MnO中阴、阳离子的配位数都为6,MnO的晶胞参数=2r(Mn2+)+2r(O2-),αˊnm=2r(Mn2+)+2×
nm;MnO也属于NaCl型,MnO中阴、阳离子的配位数都为6,MnO的晶胞参数=2r(Mn2+)+2r(O2-),αˊnm=2r(Mn2+)+2×![]() nm,解得r(Mn2+)=(
nm,解得r(Mn2+)=(![]() )nm。
)nm。


科目:高中化学 来源: 题型:
【题目】实验室中Y形管是一种特殊的仪器,通常与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。回答下列问题:

(1)广口瓶中间那根玻璃管的作用是:__________________________________________。
(2)实验前需要将BaCl2溶液煮沸,其目的是:_________________________________。
(3)甲中发生反应的化学方程式为:____________________________________________。
(4)乙中分别加入一种常用氧化物和一种无色液体,常温下将两者混合可产生一种碱性气体。该反应的化学方程式为:____________________________________________。
(5)实验时,先使甲中产生的足量气体通入BaCl2溶液中,始终无沉淀生成。由此得出的结论是_______。
(6)向上述⑸实验所得溶液中通入乙产生的气体,产生白色沉淀,请写出发生反应的离子方程式:_____。
(7) 请指出该实验的一个不足之处:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨气和氯化氢,烧杯内盛装滴有石蕊试液的蒸馏水。下列说法错误的是

A. 在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B. 在实验室中制备干燥的氨气和氯化氢时,可选用相同的干燥剂
C. 实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D. 喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙是人体必需的常量元素,成年人每天需要800mg的钙,下列补钙的途径正确的是
A. 经常吃水果、蔬菜B. 经常饮用钙离子含量高的硬水
C. 经常饮用牛奶、豆奶D. 大量补充维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属冶炼的反应原理,错误的是( )
A. MgCl2(熔融)![]() Mg+Cl2↑ B. 2NaCl+H2
Mg+Cl2↑ B. 2NaCl+H2![]() 2Na+2HCl
2Na+2HCl
C. Fe3O4+4CO![]() 3Fe+4CO2 D. 2HgO
3Fe+4CO2 D. 2HgO![]() 2Hg+O2↑
2Hg+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四物质有如下转化关系(反应条件和部分产物已略去):A![]() B
B![]() C
C![]() D,回答下列问题:
D,回答下列问题:
(1)若A为气态氢化物和D能通过化合反应生成一种盐,则
①简述检验该盐中阳离子的方法:_____________________________________;
②写出实验室制取A的化学方程式:______________________________________;
③写出由A生成B的化学方程式:______________________________________;
④某同学用干燥的圆底烧瓶收集一瓶A气体,用滴入酚酞的水做喷泉实验,能观察到美丽的红色喷泉。用方程式解释喷泉呈红色的原因:____________________。
(2)若A与B反应能生成一种淡黄色固体单质,写出该反应的化学方程式: ________________________________________________________________。
(3)若A是金属单质,C是一种淡黄色固体,写出C生成D的离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:①氯水;②浓硫酸;③溴蒸气;④烧碱;⑤氧气;⑥酸性KMnO4溶液,其中在一定条件下可以与甲烷发生化学反应的是 ( )
A. ①②③⑤ B. ④⑤⑥ C. ③⑤ D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O所含的电子数为10NA
B. 1 mol H2O2中含有极性键的数目为3NA
C. 标准状况下,22.4 L四氯化碳所含分子数为NA
D. 32g O2和O3的混合物中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com