
【题目】如何设计实验证明氧化铝的熔点高于铝?写出实验步骤和现象。_________________
科目:高中化学 来源: 题型:
【题目】钙是人体必需的常量元素,成年人每天需要800mg的钙,下列补钙的途径正确的是
A. 经常吃水果、蔬菜B. 经常饮用钙离子含量高的硬水
C. 经常饮用牛奶、豆奶D. 大量补充维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O所含的电子数为10NA
B. 1 mol H2O2中含有极性键的数目为3NA
C. 标准状况下,22.4 L四氯化碳所含分子数为NA
D. 32g O2和O3的混合物中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
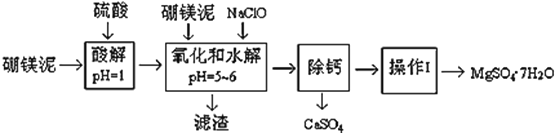
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________,___________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
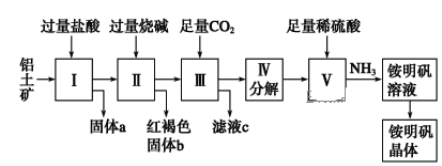
请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)滤液c显________性,日常生活中常用其溶质来________________(任写一点);
(5)向铵明矾NH4Al(SO4)2中加氢氧化钡使硫酸根离子完全沉淀化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某蛋白质的结构片段:

(1)上述蛋白质的结构片段的水解产物中不属于α氨基酸的结构简式是_____________________。
(2)上述蛋白质的结构片段水解后的氨基酸中,某氨基酸中碳、氢原子数比值最大。
①该氨基酸与NaOH反应的化学方程式为________________________。
②该氨基酸二分子缩合形成环状物质的分子式为_______________。
③该氨基酸的同分异构体中,属于硝基化合物且苯环上除硝基外只有甲基的同分异构体有________种。
(3)已知上述蛋白质结构片段的式量为364,则水解成的各氨基酸的式量之和为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com