
【题目】X、Y、Z、W、J是元素周期表前四周期中的五种常见元素![]() 其相关信息如下表:
其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | M层上有2对成对电子 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
![]() 元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
![]() 元素Y位于元素周期表第 ______ 周期第 ______ 族;
元素Y位于元素周期表第 ______ 周期第 ______ 族;
![]() 元素Z的原子最外层共有 ______ 种不同运动状态的电子;
元素Z的原子最外层共有 ______ 种不同运动状态的电子;
![]() 的基态原子核外价电子排布图是 ______ ;
的基态原子核外价电子排布图是 ______ ;
![]() 的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
【答案】 ![]() 三 VIA
三 VIA ![]()
![]() NH4NO3
NH4NO3
【解析】X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,根据构造原理,X的基态原子核外电子排布式为1s22s22p2,X为C元素;Y的M层上有2对成对电子,Y的基态原子核外电子排布式为1s22s22p63s23p4,Y为S元素;Z和Y同周期,Z的电负性大于Y,Z为Cl元素;W的一种核素的质量数为63,中子数为34,质子数为63-34=29,W为Cu元素;J的气态氢化物与J的最高价氧化物对应的水化物反应生成一种盐,J为N元素。根据元素周期表和相关化学用语作答。
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,根据构造原理,X的基态原子核外电子排布式为1s22s22p2,X为C元素;Y的M层上有2对成对电子,Y的基态原子核外电子排布式为1s22s22p63s23p4,Y为S元素;Z和Y同周期,Z的电负性大于Y,Z为Cl元素;W的一种核素的质量数为63,中子数为34,质子数为63-34=29,W为Cu元素;J的气态氢化物与J的最高价氧化物对应的水化物反应生成一种盐,J为N元素。
(1)X为C元素,C的同位素中用于测定文物年代的是![]() 。
。
(2)Y为S元素,S的原子结构示意图为 ,S元素位于元素周期表第三周期第VIA族。
,S元素位于元素周期表第三周期第VIA族。
(3)Z为Cl元素,Cl原子核外有17个电子,最外层有7个电子,Cl原子最外层有7种不同运动状态的电子。
(4)W为Cu元素,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,价电子排布式为3d104s1,价电子排布图为![]() 。
。
(5)J为N元素,J的气态氢化物为NH3,J的最高价氧化物对应的水化物为HNO3,NH3与HNO3反应的化学方程式为NH3+HNO3=NH4NO3,NH3与HNO3反应生成的盐的化学式为NH4NO3。


科目:高中化学 来源: 题型:
【题目】下列物质与酸反应产生CO2的反应速率最大的是( )
选项 | 温度 | 物质 | 酸 |
A | 25 ℃ | 石灰石粒 | 0.1 mol·L-1 盐酸 |
B | 25 ℃ | 石灰石粒 | 0.1 mol·L-1 硫酸 |
C | 50 ℃ | 石灰石粒 | 0.1 mol·L-1 盐酸 |
D | 50 ℃ | 石灰石粉 | 0.1 mol·L-1 硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列叙述错误的是
表示阿伏加德罗常数的值,下列叙述错误的是![]()
![]()
A. 标准状况下,![]() 氯气与足量水反应,转移电子数目为
氯气与足量水反应,转移电子数目为![]()
B. ![]() 中含有的质子数为
中含有的质子数为![]()
C. 12g金刚石中含有的共价键数为![]()
D. 标准状况下,![]() 氟化氢中含有氟原子的数目大于
氟化氢中含有氟原子的数目大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

![]() 该浓盐酸的物质的量浓度为 ______
该浓盐酸的物质的量浓度为 ______ ![]() .
.
![]() 取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 ______ .
取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 ______ .
A.溶液中HCl的物质的量![]() 溶液的浓度
溶液的浓度
C.溶液中![]() 的数目
的数目![]() 溶液的密度
溶液的密度
![]() 某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为
某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为![]() 稀盐酸.
稀盐酸.
![]() 该学生需要量取 ______ mL上述浓盐酸进行配制.
该学生需要量取 ______ mL上述浓盐酸进行配制.
![]() 配制时,其正确的操作顺序是
配制时,其正确的操作顺序是![]() 用字母表示,每个字母只能用一次
用字母表示,每个字母只能用一次![]() ______ ;
______ ;
A.用30mL水洗涤烧杯![]() 次,洗涤液均注入容量瓶,振荡
次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水![]() 约
约![]() 的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线![]() 处
处
![]() 在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?![]() 填“偏高”或“偏低”或“无影响”
填“偏高”或“偏低”或“无影响”![]() .
.
I、用量筒量取浓盐酸时俯视观察凹液面 ______
II、用量筒量取浓盐酸后,洗涤量筒![]() 次,洗涤液也转移到容量瓶 ______
次,洗涤液也转移到容量瓶 ______
III、溶液注入容量瓶前没有恢复到室温就进行定容 ______
![]() 若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d
若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为d![]() ,则此溶液的物质的量浓度为 ______
,则此溶液的物质的量浓度为 ______ ![]() 填字母
填字母![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是
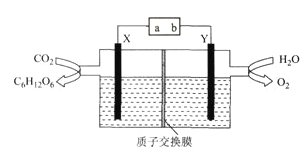
A. 电源a极为正极
B. 该装置中Y电极发生还原反应
C. X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O
D. 理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物有很多,用途很广。如磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态锡原子的价电子排布式为_________,据此推测,锡的最常见正价是_________ 。
(2)磷化铜与水反应产生有毒的磷化氢(PH3),PH3分子的中心原子的杂化方式是_________ 。
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn____P(填“>”“<”或“=”)。
(4)比较S、P的第一电离能I1(S)____I1(P)(填“>”“<”或“=”)。某磷青铜晶胞结构如下图所示:

(5)该晶体中P原子位于_______空隙中。
(6)若晶体密度为ag/cm3,P与最近的Cu原子核间距为______pm(用含NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.由同一种元素组成的物质一定是纯净物
B.两种元素只能组成一种化合物
C.一种元素在同一种化合物中只能显示一种价态
D.金属元素在化合物中只显示正化合价,而非金属元素在化合物中可以显示正化合价或负化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置验证SO2的某些性质(加热及夹持装置略去)。
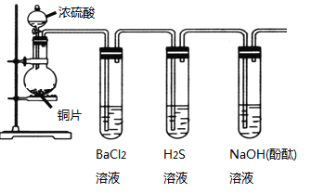
(1)装有浓硫酸的仪器名称是____________。
(2)铜与浓硫酸反应的化学方程式是____________________________________。
(3)能验证SO2具有氧化性的实验现象是_____________________________。
(4)装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是______,_____。
(5)写出SO2显示还原性并生成白色沉淀的总的离子方程式____________________________。
(6)能验证SO2具有酸性氧化物的通性的实验现象_____。若通入过量的SO2,则其总反应的离子反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:
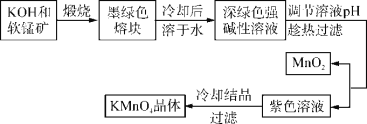
已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO![]() )在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO
)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO![]() 会发生自身氧化还原反应,生成MnO
会发生自身氧化还原反应,生成MnO![]() 和MnO2。
和MnO2。
回答下列问题:
(1)KOH的电子式为____________。
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为____________。
(3)趁热过滤的目的是_____________________________________________。
(4)已知20 ℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1 g、34 g、217 g,则从理论上分析,选用下列酸中________(填标号),得到的高锰酸钾晶体纯度更高。
A.稀硫酸 B.浓盐酸 C.醋酸 D.稀盐酸
(5)产品中KMnO4的定量
①配制浓度为0.1250 mg· mL-1的KMnO4标准溶液100 mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。

③称取KMnO4样品(不含K2MnO4)0.1250 g按步骤①配得产品溶液1000 mL,取10 mL稀释至100 mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为________。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com