
【题目】下列物质与酸反应产生CO2的反应速率最大的是( )
选项 | 温度 | 物质 | 酸 |
A | 25 ℃ | 石灰石粒 | 0.1 mol·L-1 盐酸 |
B | 25 ℃ | 石灰石粒 | 0.1 mol·L-1 硫酸 |
C | 50 ℃ | 石灰石粒 | 0.1 mol·L-1 盐酸 |
D | 50 ℃ | 石灰石粉 | 0.1 mol·L-1 硫酸 |
A.AB.BC.CD.D
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是 ( )
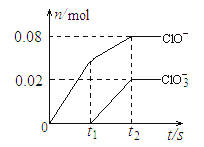
A. 苛性钾溶液中KOH的质量是5.6 g B. 反应中转移电子的物质的量是0.18mol
C. 在酸性条件下 ClO- 和ClO3-可生成Cl2 D. 一定有3.136 L氯气参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A.Na+、Mg2+、OH-、Cl-B.H+、Ca2+、CO32-、NO3-
C.K+、Zn2+、NO3-、SO42-D.Na+、HCO3-、OH-、Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律. Ⅰ.甲同学设计了如如图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。

(1)甲同学在连接好仪器后,加入药品之前的具体操作是:______________
(2)要证明氮、碳、硅非金属性强弱,在 A 中加________________溶液,B 中加___________溶液,C 中加___________溶液,将观察到C 中________________的现象.但花花认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_____________。
(3)为避免上述问题,应在 B、C 之间增加一个盛有足量_____的洗气装置.改进后C 中发生反应的离子方程式是________________.
Ⅱ.丙同学设计了如如图装置来验证卤族元素性质的递变规律.A、B、C 三处分别是沾有NaBr 溶液的棉花、湿润淀粉 KI 试纸、湿润红纸.

(4)请写出浓盐酸与高锰酸钾反应的离子方程式:______________
(5)A 中棉花颜色变_______,则说明非金属性 Cl>Br;向 NaBr 和 KI 的混合溶液中,通入足量的 Cl2 充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。

根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有________________。
(2)溶液X中关于硝酸根离子的判断,正确的是______(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)气体F的电子式为____________,化合物I中含有的化学键类型有________________。
(4)转化①的离子方程式为_______________________________________________________。
转化⑦的离子方程式为_______________________________________________________。
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈大齐高铁的通车,标志我国高寒地区高铁技术领先世界,车厢大部分采用铝合金材料制造,这是因为铝合金
A. 质量轻,强度大,抗腐蚀能力比较强 B. 具有比较活泼的化学性质
C. 各种成分在自然界中含量丰富,容易获取 D. 比纯铝熔点高,耐高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、J是元素周期表前四周期中的五种常见元素![]() 其相关信息如下表:
其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | M层上有2对成对电子 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
![]() 元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
![]() 元素Y位于元素周期表第 ______ 周期第 ______ 族;
元素Y位于元素周期表第 ______ 周期第 ______ 族;
![]() 元素Z的原子最外层共有 ______ 种不同运动状态的电子;
元素Z的原子最外层共有 ______ 种不同运动状态的电子;
![]() 的基态原子核外价电子排布图是 ______ ;
的基态原子核外价电子排布图是 ______ ;
![]() 的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com