
【题目】FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
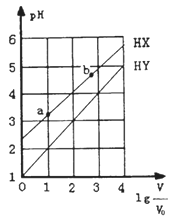
A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg![]() =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:

(l)等质量的以上三种物质完全燃烧时,消耗O2的量最多的是______(填分子式),该烃与氧气反应的化学方程式为_________;
(2)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____(填结构简式), 生成水最多的是_______(填结构式);
(3)相同状况下,等体积的以上下种物质完全燃烧时,消耗O2的量最多的是_____(填物质名称),该烃电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是呼吸面具中常用的供氧剂,下列关于Na2O2的叙述正确的是( )
A. Na2O2中阴、阳离子的个数比为1:1
B. Na2O2分别与水、CO2反应,产生相同量的O2时,需要水和CO2的物质的量相等
C. Na2O2与CO2反应过程中,只做氧化剂
D. Na2O2与SO2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2 H2 S(g) ![]() 2H2(g)+S2(g)
2H2(g)+S2(g) ![]() H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,![]() H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol·L-1的HClO2和1mol·L-1的HMnO4两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法正确的是( )
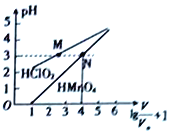
A. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
B. 在0≤pH≤5时,HMnO4溶液满足:pH=1g![]()
C. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH:NaMnO4>NaClO2
D. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁三种金属,分别与足量的同体积同浓度的盐酸反应,同温同压下,产生相同体积的氢气,则反应中( )
A. 金属失去电子数目相等 B. 消耗金属的质量相等
C. 消耗金属的物质的量相等 D. 消耗的HCl的量不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
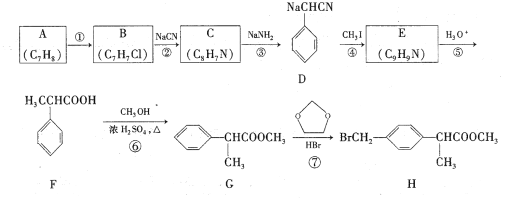
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是未来最理想的新能源。
(1)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+_____![]() _____ +_____④2HgO
_____ +_____④2HgO![]() 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________。
(2)已知2H2(g) + O2(g) ==2H2O(l);△H=–571.6 kJ·![]()
C3H8(g) +5O2(g) ==3CO2(g) + 4H2O(l);△H=–2220.0 kJ·![]() ,
,
试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com