
【题目】处于平衡状态的反应2 H2 S(g) ![]() 2H2(g)+S2(g)
2H2(g)+S2(g) ![]() H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,![]() H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
【答案】B
【解析】
试题分析:A.加入催化剂,反应途径将发生改变,但是反应的![]() H不会改变。错误。B.升高温度,正逆反应速率都增大,对于可能反应来说,升高温度,根据平衡移动原理:化学平衡向吸热反应方向移动。由于H2S分解反应是吸热反应,所以平衡正向移动,H2S分解率增大。正确。C.该反应是个反应前后气体体积不等的反应。增大压强,化学平衡气体体积减小的反应方向即向向逆反应方向移动。由于正反应为吸热反应,所以平衡逆向移动将会引起体系温度升高。错误。D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小。压强的影响大于浓度增大的影响,根据平衡移动原理:增大压强,化学平衡向褪去体积减小的方向移动你,即向逆反应方向移动。但平衡移动的趋势是很微弱的,平衡移动只能减弱这种改变,但不能消除这种改变,因此H2的浓度不原来还是增大很多。错误。
H不会改变。错误。B.升高温度,正逆反应速率都增大,对于可能反应来说,升高温度,根据平衡移动原理:化学平衡向吸热反应方向移动。由于H2S分解反应是吸热反应,所以平衡正向移动,H2S分解率增大。正确。C.该反应是个反应前后气体体积不等的反应。增大压强,化学平衡气体体积减小的反应方向即向向逆反应方向移动。由于正反应为吸热反应,所以平衡逆向移动将会引起体系温度升高。错误。D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小。压强的影响大于浓度增大的影响,根据平衡移动原理:增大压强,化学平衡向褪去体积减小的方向移动你,即向逆反应方向移动。但平衡移动的趋势是很微弱的,平衡移动只能减弱这种改变,但不能消除这种改变,因此H2的浓度不原来还是增大很多。错误。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积可能是
A. 504mL B. 168mL C. 336mL D. 224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种锂铜可充电电池,工作原理如图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法不正确的是

A. 陶瓷片允许Li+通过,不允许水分子通过
B. 放电时,N为电池的正极
C. 充电时,阴极反应为:Li+ +e-=Li
D. 充电时,接线柱A应与外接电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g)![]() 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
A. 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3
B. 平衡混合物体积是反应开始前的3/5
C. 平衡混合物中各物质的量浓度相等
D. 单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:2 时,实际参加反应的FeS 与被还原的HNO3的物质的量之比为 ( )
A. 1:4 B. 1:5 C. 1:6 D. 1:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①月球上某矿石经处理得到的MgO中含有少量SiO2,用NaOH溶液除去SiO2的化学方程式为______。
②MgO与炭粉和氯气在一定条件下反应可制备MgCl2,尾气中的氯气可用足量冷的NaOH溶液完全吸收,则生成的盐为_________、_________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若下列图像中横轴代表所加溶液体积,纵坐标代表生成沉淀质量,则各项描述中与图像能对应的是( )

A. 图①可能是MgCl2、AlCl3溶液逐滴加氨水至过量
B. 图②可能是AlCl3溶液逐滴加NaOH溶液至过量
C. 图③可能是NaAlO2溶液滴加稀盐酸至过量
D. 图④可能是含一定量HCl的AlCl3溶液逐滴加氨水至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
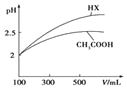
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com