
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
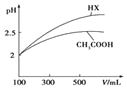
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
【答案】 a BD 大于 稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大 9.9×10-7
【解析】(1)据电离平衡常数可以知道,酸性由强到弱的顺序为:![]() ,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,正确答案: a<d<c<b 。
,弱酸的酸性越弱其酸根离子的水解程度越大,溶液碱性越强,所以pH由小到大排列顺序是a<d<c<b,正确答案: a<d<c<b 。
(2) 0.1mol·L-1CH3COOH溶溶液加水稀释过程中,氢离子与醋酸根离子物质的量增大,浓度减小,酸性减弱;氢离子浓度减小, A错误;加水稀释过程中,氢离子物质的量增大,醋酸分子物质的量减小,所以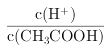 增大,B正确;水的离子积常数不变,C错误;醋酸溶液加水稀释时酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,所以c(OH-)/c(H+)增大,D正确;醋酸的电离平衡常数不变,E错误;正确答案:BD。
增大,B正确;水的离子积常数不变,C错误;醋酸溶液加水稀释时酸性减弱,氢离子浓度减小,氢氧根离子浓度增大,所以c(OH-)/c(H+)增大,D正确;醋酸的电离平衡常数不变,E错误;正确答案:BD。
(3) pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,所以HX的酸性大于醋酸,则HX的电离平衡常数大于醋酸;正确答案:大于;稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大。
(4) CH3COOH与CH3COONa的混合溶液中,存在电荷守恒: c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(CH3COO-)- c(Na+)= c(H+)- c(OH-)=10-6-10-8=9.9×10-7;正确答案:9.9×10-7。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2 H2 S(g) ![]() 2H2(g)+S2(g)
2H2(g)+S2(g) ![]() H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,![]() H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( )

A. 用CCl4代替水,测得氢气的体积更准确
B. 量气管压入漏斗的水过多而溢出,会导致测定失败
C. 必须待体系温度降低到0℃时才可进行读数
D. 上提水准管,量气管液面高度不断改变,说明装置漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50mL0.50mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如右下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是

A. 如右图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.55 mol/L盐酸与40 mL 0.50 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,化学反应的反应热前者大于后者的一组是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1;
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;
②2H2(g)+O2(g)=2H2O(l)△H1;
H2(g)+O2(g)=H2O(l)△H2
③t℃时,在一定条件下,将1molSO2和1molO2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g)△H1;
CaO(s)+H2O(l)=Ca(OH)2(s)△H2
A. ③④ B. ②③ C. ①② D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是未来最理想的新能源。
(1)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+_____![]() _____ +_____④2HgO
_____ +_____④2HgO![]() 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________。
(2)已知2H2(g) + O2(g) ==2H2O(l);△H=–571.6 kJ·![]()
C3H8(g) +5O2(g) ==3CO2(g) + 4H2O(l);△H=–2220.0 kJ·![]() ,
,
试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
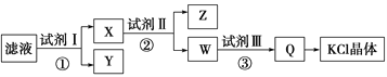
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以铁丝和 Cl2(2Fe+3Cl2 ![]() 2FeCl3)为原料进行下列三个实验。下列选项正确的是( )
2FeCl3)为原料进行下列三个实验。下列选项正确的是( )
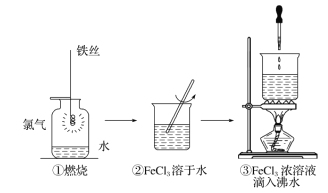
A. 实验①、 ③反应制得的物质均为纯净物
B. 实验①中的反应既是氧化还原反应,又是四种基本反应类型中的反应
C. 实验③化学方程式为 FeCl3+3H2O==Fe(OH)3↓+3HCl
D. 实验①、 ②所涉及的物质均为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等。
(1) 某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
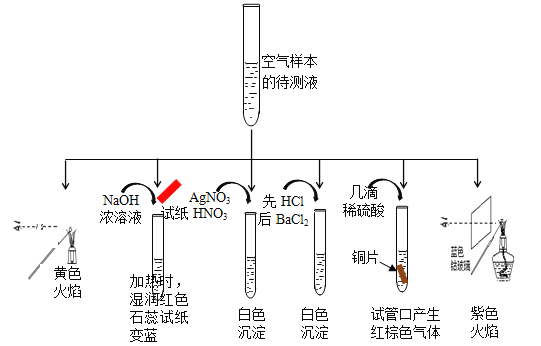
①该实验能确认存在的阳离子是 。
②该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③根据该实验能否确定样本中含有SO32-, (填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是 。
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确的是 (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
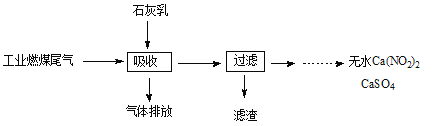
①CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com