
【题目】如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( )

A. 用CCl4代替水,测得氢气的体积更准确
B. 量气管压入漏斗的水过多而溢出,会导致测定失败
C. 必须待体系温度降低到0℃时才可进行读数
D. 上提水准管,量气管液面高度不断改变,说明装置漏气
科目:高中化学 来源: 题型:
【题目】1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积可能是
A. 504mL B. 168mL C. 336mL D. 224mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①月球上某矿石经处理得到的MgO中含有少量SiO2,用NaOH溶液除去SiO2的化学方程式为______。
②MgO与炭粉和氯气在一定条件下反应可制备MgCl2,尾气中的氯气可用足量冷的NaOH溶液完全吸收,则生成的盐为_________、_________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若下列图像中横轴代表所加溶液体积,纵坐标代表生成沉淀质量,则各项描述中与图像能对应的是( )

A. 图①可能是MgCl2、AlCl3溶液逐滴加氨水至过量
B. 图②可能是AlCl3溶液逐滴加NaOH溶液至过量
C. 图③可能是NaAlO2溶液滴加稀盐酸至过量
D. 图④可能是含一定量HCl的AlCl3溶液逐滴加氨水至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
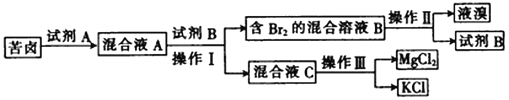
回答下列问题:
(1)若试剂A是一种有色气体单质,则A是_______(填化学式);
(2)“操作II”是_______,“操作III”是_______。(填字母)
a.蒸发 b.蒸馏 c.分液 d.重结晶
(3)试剂B可能是下列物质中的________。(填字母)
a.饱和NaCl溶液 b.CCl4 c.NaOH d.乙醇
Ⅱ.一种工业制备SrCl2·6H2O的生产流程如下图所示:
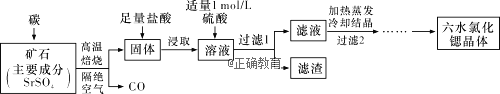
已知:①M(SrCl2·6H2O)=267g·mol-1;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)加入硫酸溶液的目的是______________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol·L1 (注:此时滤液中Ba2+浓度为1×105 mol·L1)。
(2)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×102 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_______(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,下列有关说法正确的是
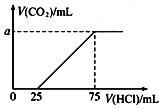
A. 原溶液中NaOH的物质的量为0.75 mol
B. 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C. 通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3
D. 纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1) a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3四种溶液的物质的量浓度均为0.1mol·L-1的,pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(______)
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
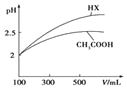
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)=___________________mol·L-1(填精确值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室做了5个实验:请选择符合实际情况的图象:

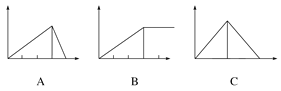
(1)向AlCl3溶液中逐滴加入稀氨水直至过量,沉淀的质量随氨水加入量的变化情况________
(2)向AlCl3溶液中逐滴加入NaOH溶液直至过量,沉淀的质量随NaOH溶液加入量的变化情况________
(3)向澄清石灰水中通入CO2直至过量,沉淀质量随CO2通入量的变化情况_____
(4)向Al2(SO4)3和MgSO4的混合溶液中加入NaOH溶液直至过量,沉淀质量随NaOH溶液加入量的变化情况________
(5)向NaOH溶液中逐滴加入AlCl3溶液至过量,沉淀质量随AlCl3加入量的变化情况_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com