
【题目】Ⅰ.海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
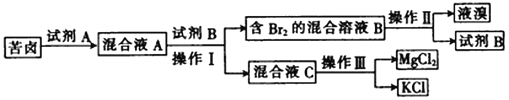
回答下列问题:
(1)若试剂A是一种有色气体单质,则A是_______(填化学式);
(2)“操作II”是_______,“操作III”是_______。(填字母)
a.蒸发 b.蒸馏 c.分液 d.重结晶
(3)试剂B可能是下列物质中的________。(填字母)
a.饱和NaCl溶液 b.CCl4 c.NaOH d.乙醇
Ⅱ.一种工业制备SrCl2·6H2O的生产流程如下图所示:
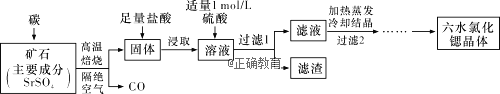
已知:①M(SrCl2·6H2O)=267g·mol-1;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)加入硫酸溶液的目的是______________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol·L1 (注:此时滤液中Ba2+浓度为1×105 mol·L1)。
(2)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×102 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_______(保留4位有效数字)。
【答案】Cl2 bdb除去Ba2+杂质0.03加入最后一滴标准液,溶液由无色变为红色,且30 s不褪色93.45%
【解析】
Ⅰ、海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物,加入试剂A为氧化剂,发生反应生成溴单质,加入萃取剂四氯化碳萃取分液得到含溴单质的混合溶液B和混合溶液C,混合溶液B通过蒸馏得到液溴和试剂B为四氯化碳,混合溶液C通过结晶法分离氯化镁和氯化钾。
(1)若试剂A是一种有色气体单质,则A是Cl2 ,氯气氧化溴离子生成溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,故答案为:Cl2;
(2)操作II”是从萃取剂中分离出溴单质,利用物质沸点不同,控制温度通过蒸馏方法分离得到溴单质,操作III是浓缩结晶的方法分离混合物,可以利用重结晶方法分离氯化镁和氯化钠,故答案为:b;d;
(3)试剂B是萃取剂,萃取剂与水不互溶,且溴不易溶于水,易溶于萃取剂,且不发生反应,acd水溶液中不能分层不能做萃取剂,四氯化碳不溶于水,溴单质再四氯化碳中溶解度大于水中可以做萃取剂,故选b,故答案为:b;
Ⅱ、(1)经盐酸浸取后的溶液中含有少量Ba2+杂质,加入硫酸的目的是除去溶液中Ba2+杂质,由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=![]() mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=
mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=![]() mol/L=0.03mol/L,故答案为:除去溶液中Ba2+杂质;0.03;
mol/L=0.03mol/L,故答案为:除去溶液中Ba2+杂质;0.03;
(2)①Ag+ 完全以AgSCN白色沉淀的形式析出后,再滴加KSCN溶液,就会与Fe3+产生络合物是溶液变为红色,因此滴定达到终点时溶液由无色变为血红色,且30 s不褪色,故答案为:溶液由无色变为血红色,且30 s不褪色;
②n(NH4SCN)=0.2000mol/L×0.02L=4.0×10-3mol,Ag+以AgSCN白色沉淀的形式析出,所以溶液中剩余的Ag+的物质的量为:n(Ag+)=4.0×10-3mol,则与Cl-反应的Ag+的物质的量为:n(Ag+)=1.100×10-2 mol-4.0×10-3mol=7.0×10-3mol,1.000g产品中SrCl26H2O的物质的量为:n(SrCl26H2O)=![]() ×n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=3.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:
×n(Ag+)=3.5×10-3mol,1.000g产品中SrCl26H2O的质量为:m(SrCl26H2O)=3.5×10-3mol×267 g/mol=0.9345g,所以产品纯度为:![]() ×100%=93.45%,故答案为:93.45%。
×100%=93.45%,故答案为:93.45%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:

(l)等质量的以上三种物质完全燃烧时,消耗O2的量最多的是______(填分子式),该烃与氧气反应的化学方程式为_________;
(2)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____(填结构简式), 生成水最多的是_______(填结构式);
(3)相同状况下,等体积的以上下种物质完全燃烧时,消耗O2的量最多的是_____(填物质名称),该烃电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铁三种金属,分别与足量的同体积同浓度的盐酸反应,同温同压下,产生相同体积的氢气,则反应中( )
A. 金属失去电子数目相等 B. 消耗金属的质量相等
C. 消耗金属的物质的量相等 D. 消耗的HCl的量不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
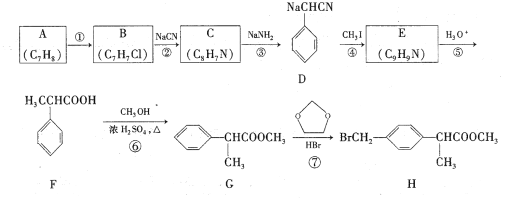
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( )

A. 用CCl4代替水,测得氢气的体积更准确
B. 量气管压入漏斗的水过多而溢出,会导致测定失败
C. 必须待体系温度降低到0℃时才可进行读数
D. 上提水准管,量气管液面高度不断改变,说明装置漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水玻璃中通入少量的CO2气体,充分反应后加热蒸干,再高温充分灼烧,冷却后所得的固体物质为()
A. Na2SiO3 B. Na2SiO3与Na2CO3
C. SiO2与Na2CO3 D. SiO2、Na2SiO3及Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50mL0.50mol/L 的盐酸与50mL 0.55mol/L 的NaOH溶液在如右下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是

A. 如右图条件下实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎纸条的作用是固定小烧杯
D. 若改用60 mL 0.55 mol/L盐酸与40 mL 0.50 mol/L的NaOH溶液进行反应,从理论上说所求放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是未来最理想的新能源。
(1)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O![]() CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg![]() HgBr2+H2
HgBr2+H2
③HgBr2+_____![]() _____ +_____④2HgO
_____ +_____④2HgO![]() 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________。
(2)已知2H2(g) + O2(g) ==2H2O(l);△H=–571.6 kJ·![]()
C3H8(g) +5O2(g) ==3CO2(g) + 4H2O(l);△H=–2220.0 kJ·![]() ,
,
试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)

回答下列问题:
(1)按如图所示的装置连接完仪器,在加药品之前应该做的操作是______________
(2)装置A中液体试剂选用_____________________________,
(3)装置B的作用是___________________________________,装置C的作用是____________________________________,装置E中碱石灰的作用是____________________________________________,
(4)装置D中发生反应的化学方程式是______________________________________
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com