
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)

回答下列问题:
(1)按如图所示的装置连接完仪器,在加药品之前应该做的操作是______________
(2)装置A中液体试剂选用_____________________________,
(3)装置B的作用是___________________________________,装置C的作用是____________________________________,装置E中碱石灰的作用是____________________________________________,
(4)装置D中发生反应的化学方程式是______________________________________
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
【答案】检查装置的气密性 6mol/LHCl 除去CO2中的HCl 干燥CO2 除去O2中的CO2 2Na2O2 + 2CO2 = 2Na2CO3 + O2 78%
【解析】
(1)按如图所示的装置连接完仪器,在加药品之前应该做的操作是检查装置的气密性。答案:检查装置的气密性。
(2)实验室中用CaCO3与盐酸反应制取CO2而不用H2SO4,原因是H2SO4,与CaCO3反应生成的CaSO4溶解度较小,会覆盖在CaCO3固体表面,阻止反应的继续进行,所以装置A中液体试剂选用6mol/LHCl。 答案:6mol/LHCl。
(3)装置B、C为净化CO2的装置,装置E是除去氧气中的二氧化碳和水。因为选择的是6mol/LHCl做反应物,HCl具有挥发性,所以CO2中混有HCl和水蒸气,因此装置B的试剂是为了除去HCl,装置C是除去水蒸气。装置E中碱石灰的作用是除去O2中的CO2。答案:除去CO2中的HCl;干燥CO2 ;除去O2中的CO2。
(4)装置D中装的是Na2O2,所发生反应的化学方程式是2Na2O2+ 2CO2 = 2Na2CO3 + O2,答案:Na2O2+2CO2=2Na2CO3+O2。
(5)根据反应2Na2O2+ 2CO2 = 2Na2CO3 + O2中Na2O2与O2的关系,可由生成O2的量计算.由标准状况气体体积为224 mL知,n(O2)=0.01mol设样品中含Na2O2的质量为xg:
2Na2O2+ 2CO2 = 2Na2CO3 + O2
78![]() 2 1
2 1
x 0.01mol,解得x=1.56g
Na2O2试样的纯度为1.56g /2.0 g![]() 100
100![]() =78%,答案:78%。
=78%,答案:78%。


科目:高中化学 来源: 题型:
【题目】Ⅰ.海水晒盐后所得的苦卤中含有较高浓度的MgCl2、KCl以及金属溴化物。以下是苦卤化学分离的过程。
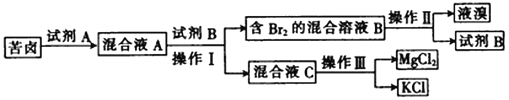
回答下列问题:
(1)若试剂A是一种有色气体单质,则A是_______(填化学式);
(2)“操作II”是_______,“操作III”是_______。(填字母)
a.蒸发 b.蒸馏 c.分液 d.重结晶
(3)试剂B可能是下列物质中的________。(填字母)
a.饱和NaCl溶液 b.CCl4 c.NaOH d.乙醇
Ⅱ.一种工业制备SrCl2·6H2O的生产流程如下图所示:
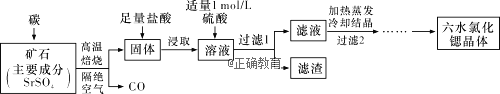
已知:①M(SrCl2·6H2O)=267g·mol-1;②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10;③经盐酸浸取后,溶液中有Sr2+和Cl-及少量Ba2+。
(1)加入硫酸溶液的目的是______________;为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol·L1 (注:此时滤液中Ba2+浓度为1×105 mol·L1)。
(2)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×102 mol的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为_______(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某实验小组利用如图装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯。
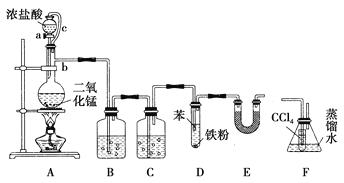
反应物和产物的相关数据列表如下:
密度/g·cm-3 | 沸点/℃ | 水中溶解性 | |
苯 | 0.879 | 80.1 | 微溶 |
氯苯 | 1.11 | 131.7 | 不溶 |
请按要求回答下列问题。
(1)仪器b的名称是________。
(2)A装置中制备Cl2的离子方程式为______________________________。
(3)氯气在通入D之前需净化干燥,则装置C中所加试剂的名称为________。
(4)D中通入氯气后,先看到苯呈黄色,片刻试管液面上方有白雾产生,装置E的作用是________。
(5)为证明氯气和苯发生的是取代反应而不是加成反应,该小组用装置F说明,则装置F置于______之间(填字母),F中小试管内CCl4的作用是________,还需使用的试剂是________。
(6)D中混合物经过滤除铁、加水及NaOH溶液洗涤、无水氯化钙干燥等分离操作后得粗氯苯,粗氯苯中还含有的主要杂质为________,要进一步提纯,下列操作中必需的是________(填入正确选项前的字母)。
A.重结晶 B.分液 C.萃取 D.蒸馏
(7)已知D中加入5 mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为________%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向4L恒容密闭容器中充入2 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是 ( )
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4 mol PCl3、4 mol Cl2,达到平衡时,则此反应的化学平衡常数为0.025
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室做了5个实验:请选择符合实际情况的图象:

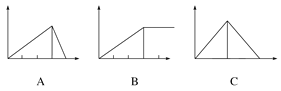
(1)向AlCl3溶液中逐滴加入稀氨水直至过量,沉淀的质量随氨水加入量的变化情况________
(2)向AlCl3溶液中逐滴加入NaOH溶液直至过量,沉淀的质量随NaOH溶液加入量的变化情况________
(3)向澄清石灰水中通入CO2直至过量,沉淀质量随CO2通入量的变化情况_____
(4)向Al2(SO4)3和MgSO4的混合溶液中加入NaOH溶液直至过量,沉淀质量随NaOH溶液加入量的变化情况________
(5)向NaOH溶液中逐滴加入AlCl3溶液至过量,沉淀质量随AlCl3加入量的变化情况_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用空气吹出法提取溴的部分流程如下:

下列说法错误的是()
A. ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O =5Br-+BrO3-+6HCO3-
B. 第③步,需加入氧化性酸,才能将Br-氧化为Br2
C. B溶液颜色要比A溶液深
D. 第④步,采用的是蒸馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_______________________________________________________。
(2)B为0.1 mol·L-1Na2CO3溶液,该溶液显碱性的原因为:______________。(写离子方程式)
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________以抑制其水解。把B和C溶液混合,发生反应的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或有关物质性质的描述正确的是
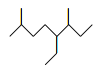
A. 如上图所示的键线式表示的烃的名称为:3-甲基-4-乙基-7-甲基辛烷
B. 符合分子式C3H8O的醇有3种不同的结构
C. 乙烯在一定条件下能发生加成反应、加聚反应,还能被酸性高锰酸钾溶液氧化
D. 治疗疟疾的青蒿素的结构简式为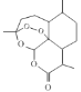 ,分子式是Cl5H20O5
,分子式是Cl5H20O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com