
【题目】铜的化合物有很多,用途很广。如磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态锡原子的价电子排布式为_________,据此推测,锡的最常见正价是_________ 。
(2)磷化铜与水反应产生有毒的磷化氢(PH3),PH3分子的中心原子的杂化方式是_________ 。
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn____P(填“>”“<”或“=”)。
(4)比较S、P的第一电离能I1(S)____I1(P)(填“>”“<”或“=”)。某磷青铜晶胞结构如下图所示:

(5)该晶体中P原子位于_______空隙中。
(6)若晶体密度为ag/cm3,P与最近的Cu原子核间距为______pm(用含NA的代数式表示)。
【答案】5s25p2+2、+4sp3<<由铜原子形成的正八面体5×109×![]()
【解析】
(1) 锡元素的核电荷数为50,则基态原子的电子排布式为1s22s22p63s23p63d104s24p64d105s25p2,故其价电子排布式为5s25p2;据此推测,锡的最常见正价是+2、+4;
(2)PH3分子中价层电子对个数=σ键个P数+孤电子对个数=3+![]() (5-3×1)=4,所以磷原子采用sp3杂化;
(5-3×1)=4,所以磷原子采用sp3杂化;
(3)根据元素的电负性在周期表中的递变规律判断,同周期元素从左到右元素的电负性逐渐增强,同主族元素从上到下电负性逐渐减弱;磷青铜中的锡、磷两元素电负性的大小为Sn<P;
(4)P的原子外层电子为半充满状态,第一电离能较大,故S、P的第一电离能I1(S) <I1(P);
(5)根据晶胞结构可知,该晶体中P原子位于由铜原子形成的正八面体空隙中;
(6)根据晶胞结构可知,P与最近的Cu原子核间距为晶胞边长的一半,晶胞的边长是![]() ,所以P与最近的Cu原子核间距为5×109×
,所以P与最近的Cu原子核间距为5×109×![]() pm。
pm。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律. Ⅰ.甲同学设计了如如图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。

(1)甲同学在连接好仪器后,加入药品之前的具体操作是:______________
(2)要证明氮、碳、硅非金属性强弱,在 A 中加________________溶液,B 中加___________溶液,C 中加___________溶液,将观察到C 中________________的现象.但花花认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_____________。
(3)为避免上述问题,应在 B、C 之间增加一个盛有足量_____的洗气装置.改进后C 中发生反应的离子方程式是________________.
Ⅱ.丙同学设计了如如图装置来验证卤族元素性质的递变规律.A、B、C 三处分别是沾有NaBr 溶液的棉花、湿润淀粉 KI 试纸、湿润红纸.

(4)请写出浓盐酸与高锰酸钾反应的离子方程式:______________
(5)A 中棉花颜色变_______,则说明非金属性 Cl>Br;向 NaBr 和 KI 的混合溶液中,通入足量的 Cl2 充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由Na2S、Na2SO3、Na2SO4组成的固体混合物中,已知S的质量分数为25.6%,则氧的质量分数为
A. 36.8%B. 37.6%C. 51.2%D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a( )、b(
)、b(![]() )、c(
)、c( )
)
A. a、b、c均能与溴水发生加成反应
B. a、b、c的分子式均为C8H8
C. a的所有原子一定处于同一一平面
D. b的二氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、J是元素周期表前四周期中的五种常见元素![]() 其相关信息如下表:
其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | M层上有2对成对电子 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
![]() 元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
![]() 元素Y位于元素周期表第 ______ 周期第 ______ 族;
元素Y位于元素周期表第 ______ 周期第 ______ 族;
![]() 元素Z的原子最外层共有 ______ 种不同运动状态的电子;
元素Z的原子最外层共有 ______ 种不同运动状态的电子;
![]() 的基态原子核外价电子排布图是 ______ ;
的基态原子核外价电子排布图是 ______ ;
![]() 的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的化学式为______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据信息填空:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生反应2FeCl3 +Cu ===2FeCl2 +CuCl2,若将此反应设计成原电池,则负极所用的电极材料为____;当线路中转移0.2mol电子时,则被腐蚀的铜的质量为____。
(2)如图所示,把试管放入盛有25℃的饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,可观察到溶液变浑浊,试回答下列问题:
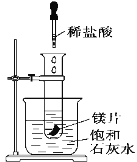
①产生上述现象的原因是___________________________;
②写出有关反应的离子方程式___________________。
③由实验推知,MgCl2和H2的总能量__________(填“大于”、“小于”或“等于”)Mg和HCl的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是

A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 氯气通入冷的氢氧化钠溶液中:Cl2 + 2OH = Cl + ClO + H2O
B. Fe与少量稀硝酸的反应:Fe + 4H+ + NO3 = Fe3+ + NO↑+ 2H2O
C. 碳酸钡溶于醋酸:BaCO3 + 2H+ = Ba2+ + H2O + CO2↑
D. 用石墨电极电解MgCl2 溶液:2Cl + 2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com