
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中国医药科技创新和人类健康事业作出了巨大贡献,我国化学家在确认青蒿素分子结构后实现了青蒿素的全合成。一种以香茅醛为原料合成青蒿素的流程如图:
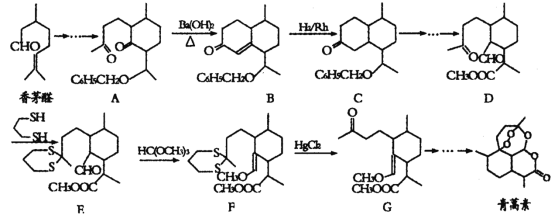
已知:羰基α—H可发生反应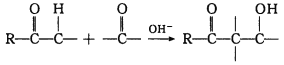
回答下列问题:
(1)青蒿素的分子式为__。根据青蒿素所含官能团,推测其可能具有的性质有___。
a.易溶于水 b.具有氧化性 c.可发生水解反应
(2)香茅醛的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有__种,其中核磁共振氢谱峰数最少的物质结构简式为__。
(3)反应A→B实际上可看作两步进行,依次发生的反应类型是__、__。
(4)C中所含官能团名称为__。
(5)通过D→E的反应,分子中引入了硫醚基团,而F→G的反应,分子中硫醚基团又被脱去,这样做的目的是__。
(6)写出由苯甲醛和氯乙烷为原料,制备苄基乙醛(![]() )的合成路线流程__(无机试剂任选)。
)的合成路线流程__(无机试剂任选)。
【答案】C15H22O5 bc 5 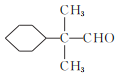 加成反应 消去反应 羰基、醚键 保护羰基 CH3CH2Cl
加成反应 消去反应 羰基、醚键 保护羰基 CH3CH2Cl![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]()
![]()
【解析】
根据流程可知,香茅醇在一定条件下转化为A,A生成B可以看成两步反应完成,A在一定条件下发生已知信息的分子内的加成反应转化为 ,
, 在浓硫酸加热条件下环上的羟基发生消去反应生成B;B在催化剂作用下与氢气发生加成反应生成C,C再经过一系列转化生成D,根据DG流程可知,为保护结构中的羰基,D中的羰基与
在浓硫酸加热条件下环上的羟基发生消去反应生成B;B在催化剂作用下与氢气发生加成反应生成C,C再经过一系列转化生成D,根据DG流程可知,为保护结构中的羰基,D中的羰基与![]() 发生反应引入硫醚基团生成E,E与HC(OCH3)3反应生成F,F在HgCl2作催化剂作用下将分子中硫醚基团脱去转化为羰基生成G,G在一定条件下反应,最终制得青蒿素;根据青蒿素的分子结构简式,分子中含有的官能团有酯基、醚基及过氧基,分子结构中不含亲氧基团,据此分析青蒿素的性质;由苯甲醛和氯乙烷为原料,制备苄基乙醛可以用氯乙烷碱性水解得乙醇,再氧化得乙醛,乙醛与苯甲醛在碱性条件下发生信息中的反应得到
发生反应引入硫醚基团生成E,E与HC(OCH3)3反应生成F,F在HgCl2作催化剂作用下将分子中硫醚基团脱去转化为羰基生成G,G在一定条件下反应,最终制得青蒿素;根据青蒿素的分子结构简式,分子中含有的官能团有酯基、醚基及过氧基,分子结构中不含亲氧基团,据此分析青蒿素的性质;由苯甲醛和氯乙烷为原料,制备苄基乙醛可以用氯乙烷碱性水解得乙醇,再氧化得乙醛,乙醛与苯甲醛在碱性条件下发生信息中的反应得到![]() ,再与氢气催化加成即可得到苄基乙醛,据此分析解答。
,再与氢气催化加成即可得到苄基乙醛,据此分析解答。
(1)根据青蒿素的结构简式,每个节点为碳原子,每个碳原子形成4个共价键,不足键由氢原子补齐,则分子式为C15H22O5;青蒿素的结构简式为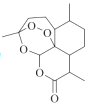 ,含有的官能团有酯基、醚基及过氧基,其中酯基可发生水解反应、过氧基具有强氧化性,整个分子结构中无亲水基,则青蒿素不可能易溶于水,故答案为bc;
,含有的官能团有酯基、醚基及过氧基,其中酯基可发生水解反应、过氧基具有强氧化性,整个分子结构中无亲水基,则青蒿素不可能易溶于水,故答案为bc;
(2)香茅醇的分子式为C10H18O,其同分异构体X含有醛基和六元碳环,且环上只有一个支链,则除六元环外,支链上有4个C原子,即为-C4H7O,因含有-CHO,则有-CH2CH2CH2CHO、-CH(CH3)CH2CHO、-CH2CH(CH3)CHO、-C(CH2CH3)CHO或-C(CH3)2CHO,共5种满足上述条件的X;其中核磁共振氢谱峰数最少,也就是分子结构中不同环境的氢原子种类最少,则该有机物的结构为高度对称,则物质的结构简式为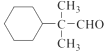 ;
;
(3)反应A→B实际上可看作两步进行,A在一定条件下发生已知信息的分子内的加成反应转化为 ,
, 在浓硫酸加热条件下环上的羟基发生消去反应生成B;
在浓硫酸加热条件下环上的羟基发生消去反应生成B;
(4)根据C的结构简式,其中所含官能团名称为羰基、醚键;
(5)通过D→E的反应,分子中引入了硫醚基团,将羰基转化为硫醚基团,而F→G的反应,分子中硫醚基团又被脱去形成羰基,则这样做的目的是可达到保护羰基,提高反应选择性的目的;
(6)由苯甲醛和氯乙烷为原料,制备苄基乙醛可以用氯乙烷碱性水解得乙醇,再氧化得乙醛,乙醛与苯甲醛在碱性条件下发生信息中的反应得到![]() ,再与氢气催化加成即可得到苄基乙醛,合成路线流程图为:CH3CH2Cl
,再与氢气催化加成即可得到苄基乙醛,合成路线流程图为:CH3CH2Cl![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]()
![]()
![]()
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
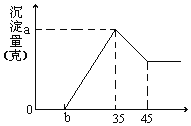
【题目】准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示。试回答下列问题:
(1)硫酸溶液的物质的量浓度。___
(2)若b=2.3时,求Al2O3和Fe2O3的质量分数。___、___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某化学小组探究硝酸银溶液的性质。
装置 | 实验序号 | 实验操作 | 实验现象 |
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
实验III | 1.向试管中滴加1mL0.1molL-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
(1)常温下,0.1mo1L-1AgNO3溶液pH约为4,请用离子方程式解释原因___。
(2)实验I中,反应的化学方程式是___。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的化学方程式是___。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___。
(4)实验中,产生黄色沉淀的离子方程式是___。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___,检验B烧杯中产物的操作及现象是___,该氧化还原反应的离子方程式是__。

(5)对比实验III和实验IV,实验III无I2生成的可能原因是___(写出两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α—甲基苯乙烯(AMS)在有机合成中用途广泛,以下是用苯为原料合成AMS,并进一步制备香料龙葵醛的路线:
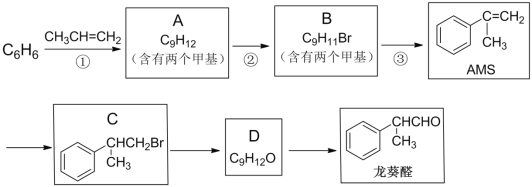
完成下列填空:
(1)反应①的反应类型是____;反应③所需的试剂与条件是____。
(2)写出反应②的化学方程式:____。
(3)AMS可以自身聚合,写出该高聚物的结构简式:____。
(4)写出同时满足下列条件的龙葵醛的一种同分异构体的结构简式:____。
i. 苯环上的一氯代物有两种
ii. 分子中没有甲基
iii. 能与金属钠产生H2
(5)有人认为仅用反应②就能得到C,事实证明产物中C的含量远远小于B。由该事实可以得到的结论是____。
(6)设计一条由AMS合成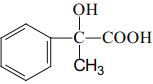 的合成路线____。(合成路线常用的表示方式为:A
的合成路线____。(合成路线常用的表示方式为:A ![]() B。。。
B。。。![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A.25℃、101Kpa时,64g SO2中含有的原子数为3NA
B.常温常压下,1mol氢气含有的原子数为2NA
C.在标准状况下,11.2L H2O含有的分子数0.5NA
D.5.6g金属铁与足量盐酸反应,失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用某物质的量浓度的NaOH溶液,滴定10.00 mL某物质的量浓度的盐酸,消耗NaOH溶液的体积V与反应后溶液的pH的图像见下图,据此推断NaOH溶液和HCl溶液的物质的量浓度是( )
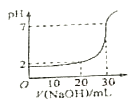
A | B | C | D | |
盐酸的浓度(mol/L) | 0.150 | 0.090 | 0.080 | 0.040 |
NaOH的浓度(mol/L) | 0.040 | 0.030 | 0.160 | 0.120 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是________________。
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类,它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式_____________。
(4)C与D反应能生成相对分子质量为100的酯,其化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究温度对氨气还原 Fe2O3 的影响(固定装置略)。完成下列填空:
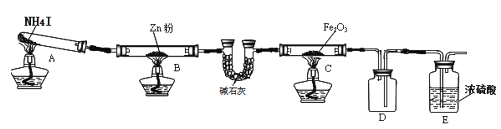
(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为 ___(至少填三种),E装置的作用是___。
(2)装置B中的反应方程式:______,D装置的作用是______。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(3)乙组得到的黑色粉末是______。
(4)甲组步骤1中反应的离子方程式为______。
(5)乙组步骤3中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com