
【题目】准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示。试回答下列问题:
(1)硫酸溶液的物质的量浓度。___
(2)若b=2.3时,求Al2O3和Fe2O3的质量分数。___、___
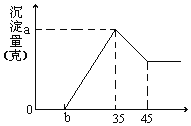
【答案】1.75mol/L 85% 12%
【解析】
(1)当加入NaOH溶液的体积为35ml时,n(NaOH)=0.035L×10mol/L=0.35mol,
此时沉淀的质量达到最大值,则此时溶液的溶质只有Na2SO4,根据Na元素守恒有n(Na2SO4)=![]() n(NaOH)=
n(NaOH)=![]() ×0.35mol=0.175mol,根据硫酸根守恒,则有:n(H2SO4)=0.175mol,所以原硫酸溶液中c(H2SO4)=
×0.35mol=0.175mol,根据硫酸根守恒,则有:n(H2SO4)=0.175mol,所以原硫酸溶液中c(H2SO4)=![]() =1.75mol/L,故答案为:稀硫酸溶液的物质的量浓度为1.75mol/L;
=1.75mol/L,故答案为:稀硫酸溶液的物质的量浓度为1.75mol/L;
(2)从35mL~45mL加入的10mL氢氧化钠完全溶解氢氧化铝,该阶段消耗的n(NaOH)=0.01L×10mol/L=0.1mol,根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.1mol,故溶液中n(Al3+)=0.1mol,n(Al2O3)=0.05mol,其质量为0.05mol×102g/mol=5.1g,故Al2O3的质量分数为![]() ×100%=85%;铝离子完全沉淀消耗的氢氧化钠为0.1mol×3=0.3mol,铁离子、铝离子完全消耗的氢氧化钠溶液的体积为35mL﹣2.3mL=32.7mL,故该阶段消耗n(NaOH)=0.0327L×10mol/L=0.327mol,故铁离子完全沉淀消耗的氢氧化钠为0.327mol﹣0.3mol=0.027mol,故n(Fe3+)=
×100%=85%;铝离子完全沉淀消耗的氢氧化钠为0.1mol×3=0.3mol,铁离子、铝离子完全消耗的氢氧化钠溶液的体积为35mL﹣2.3mL=32.7mL,故该阶段消耗n(NaOH)=0.0327L×10mol/L=0.327mol,故铁离子完全沉淀消耗的氢氧化钠为0.327mol﹣0.3mol=0.027mol,故n(Fe3+)=![]() =0.009mol,故m(Fe2O3)=0.009mol×
=0.009mol,故m(Fe2O3)=0.009mol×![]() ×160g/mol=0.72g,故Fe2O3的质量分数为
×160g/mol=0.72g,故Fe2O3的质量分数为![]() ×100%=12%,
×100%=12%,
故答案为: 85%;12%。


科目:高中化学 来源: 题型:
【题目】探究NaHSO3溶液分别与CuCl2、CuSO4溶液的反应。

已知:①![]() (深蓝色溶液)
(深蓝色溶液)
②![]()
回答下列问题:
(1)实验Ⅰ产生的无色气体为SO2。用蘸有碘水的淀粉试纸接近试管口,观察到_________________________,反应的离子方程式为______________________。
(2)对实验Ⅰ产生SO2的原因进行分析,提出两种假设:
①Cu2+水解使溶液中c(H+)增大;
②Cl-存在时,Cu2+与![]() 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
实验证明,①不合理,实验证据是____________________;②合理,实验Ⅰ反应的离子方程式有_________________________、H++![]() =SO2↑+H2O。
=SO2↑+H2O。
(3)通过分析实验Ⅰ、Ⅱ,可知:Cl-增强了Cu2+的氧化性。下述实验证实了此结论。实验方案:闭合K,电压表的指针偏转至“x”处;向U形管___________(补全实验操作及现象)。装置中,盐桥的作用是______________________________(答出两条即可)。
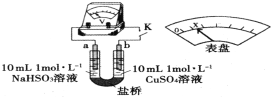
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和![]() 。设计实验,证明红色沉淀中含有Cu+__________________。
。设计实验,证明红色沉淀中含有Cu+__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
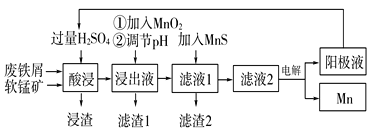
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量之比为1:1的Fe、Cu的混合粉末逐渐加入到含1mol![]() 的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
A.14gB.15gC.18gD.22.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+ 3/2O2(g) =CO2(g)+2H2O(1) ΔH1=a kJ·mol1
H2(g)+1/2O2(g) =H2O(1) ΔH2=b kJ·mol1
H2O(g) = H2O(l) ΔH3=c kJ·mol1
则 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g) ΔH,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
2CO(g) ΔH,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
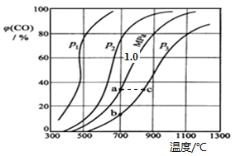
回答下列问题:
①压强p1、p2、p3的大小关系是______;Ka 、 Kb 、 Kc 为a、b、c三点对应的平衡常数,则其大小关系是______。
②900℃、1.0 MPa时,足量碳与a molCO2反应达平衡后,CO2的转化率为________ (保留三位有效数字),该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
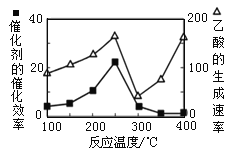
(3)以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸,CO2(g)+CH4(g) ![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_______。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_______。
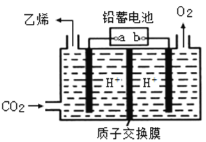
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为__________;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_____mol硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。C是海水中最多的盐,D是常见的无色液体。E和G为无色气体,其中E能使湿润的红色石蕊试纸变蓝。B、C、I、J的焰色反应为黄色,其中I可用于制发酵粉或治疗胃酸过多。

⑴F的化学式为______。E的电子式为______。
⑵写出反应①的离子方程式:______。
⑶写出反应②的化学方程式:______。
⑷写出反应③的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中国医药科技创新和人类健康事业作出了巨大贡献,我国化学家在确认青蒿素分子结构后实现了青蒿素的全合成。一种以香茅醛为原料合成青蒿素的流程如图:
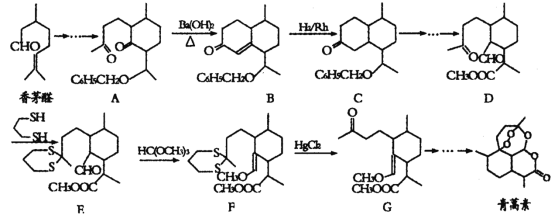
已知:羰基α—H可发生反应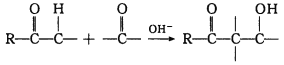
回答下列问题:
(1)青蒿素的分子式为__。根据青蒿素所含官能团,推测其可能具有的性质有___。
a.易溶于水 b.具有氧化性 c.可发生水解反应
(2)香茅醛的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有__种,其中核磁共振氢谱峰数最少的物质结构简式为__。
(3)反应A→B实际上可看作两步进行,依次发生的反应类型是__、__。
(4)C中所含官能团名称为__。
(5)通过D→E的反应,分子中引入了硫醚基团,而F→G的反应,分子中硫醚基团又被脱去,这样做的目的是__。
(6)写出由苯甲醛和氯乙烷为原料,制备苄基乙醛(![]() )的合成路线流程__(无机试剂任选)。
)的合成路线流程__(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com