
【题目】将物质的量之比为1:1的Fe、Cu的混合粉末逐渐加入到含1mol![]() 的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
A.14gB.15gC.18gD.22.5g
【答案】C
【解析】
Cu和铁1:1与硝酸发生反应,硝酸不仅起着氧化剂的作用,还起着酸的作用,且酸消耗的的量较大,由反应配平后的离子反应方程式可以得到H+与金属之间的关系,从而得到金属的质量(金属的最小质量值得就是将硝酸消耗完时候金属恰好完全反应)。根据铁、铜分别于硝酸反应的离子方程式为:3Cu+8H++ 2NO3-=3Cu2+ +2NO↑+4H2O 、Fe+4H+ +NO3-==Fe3+ +2H2O+NO↑ ,两式合并得:3Cu+3Fe+20H++5NO3-=3Cu2+ +3Fe3+ +5NO↑+10H2O;
H+~3/20 Cu~3/20 Fe
1mol 3/20mol 3/20mol
所以金属最小的质量为3/20×(64g/mol+56g/mol)=18g
答案为C。


科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)

(1)操作②为什么不用硝酸钡溶液,其理由是_______________________________;
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________________;
(3)操作③的目的是____________,其中涉及到的离子方程式是_______________;
(4)往滤液中加入盐酸的离子方程式是__________________________________;
(5)NH4HCO3在水溶液中的电离方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH =a KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH =b KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)= _。

(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,具有十分巨大的开发潜力。工业上从海水提取金属镁的流程如下:
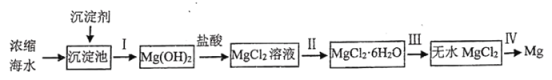
回答下列问题:
(1)沉淀剂是________________(填化学式),不选用同类的其他物质的理由是_______________。
(2)下列选项中,涉及的操作包含操作Ⅰ的是___________。
A 实验室从溴水中提取溴单质
B 除去![]() 固体中的少量NaCl
固体中的少量NaCl
C 从![]() 分解产物中获得
分解产物中获得![]()
D 用工业酒精制无水乙醇
(3)在进行步骤Ⅱ时,如果没有加入盐酸,可能产生的杂质是______________(填化学式)。
(4)一种模拟工业用![]() 制无水
制无水![]() 的实验室设计如下:
的实验室设计如下:
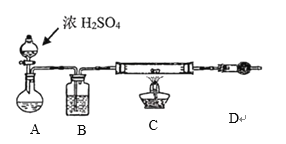
装置A中盛放液体是______________,装置D的作用是____________________________。
(5)步骤Ⅳ发生反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验KIO3中的碘元素 | 取少量KIO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 |
B | 检验石油裂解气中的乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
C | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH计测定饱和的NaClO溶液和饱和的 |
D | 硅酸胶体的制备 | 向 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种元素,已知B原子序数大于A,A与B质子数之和为27,质子数之差为5,0.9gC单质与足量盐酸作用 放出标态下1.12 L氢气,同时生成C的三氯化物,回答下列问题:
(1)C的元素符号是________________。
(2)A的原子结构示意图________。
(3)B的氢化物的电子式____________。
(4)排出三种元素最高价氧化物对应的水化物酸碱性由强到弱的顺序_____。
(5)A和C两种元素最高价氧化物对应的水化物反应的离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答:

(1)写出铜和浓硫酸反应的化学方程式:_____________。
(2)装置D中试管口放置的棉花中浸有NaOH溶液,其作用是______。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中的现象是__,B中应放置的液体是____(填序号)。
A.水 B.酸性KMnO4溶液 C.浓溴水 D.饱和NaHSO3溶液
(4)取一定质量的铜片和一定体积浓度为18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中铜和硫酸都有剩余。若想使烧瓶中剩余的铜片溶解,可向烧瓶中加入下列试剂中的____(填序号)。
A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥模型 | 分子或离子的立体构型 |
A. | SO2 | sp | 直线形 | 直线形 |
B. | HCHO | sp2 | 平面三角形 | 三角锥形 |
C. | NF3 | sp2 | 四面体形 | 平面三角形 |
D. |
| sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行的可逆反应:aA(g)+bB(g)![]() cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是

A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com