
【题目】某研究小组利用下图装置探究温度对氨气还原 Fe2O3 的影响(固定装置略)。完成下列填空:
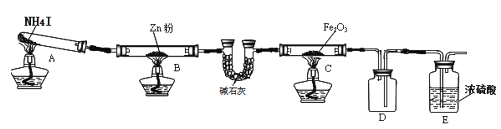
(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为 ___(至少填三种),E装置的作用是___。
(2)装置B中的反应方程式:______,D装置的作用是______。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(3)乙组得到的黑色粉末是______。
(4)甲组步骤1中反应的离子方程式为______。
(5)乙组步骤3中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______。
【答案】NH3、H2、I2(HI) 吸收多余的氨气 Zn+I2═ZnI2 安全瓶 Fe粉 Fe3O4+8H+═2Fe3++Fe2++4H2O Fe2+被氧化成Fe3+,Fe3+遇SCN-显红色 假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立 Fe2O3和FeO或Fe2O3和Fe3O4
【解析】
(1)实验时中A有大量紫红色的烟气,说明生成了碘蒸气,NH4I发生下列反应:NH4I(固)NH3(气)+HI(气),2HI(气)H2(气)+I2(气),则NH4I的分解产物为 NH3、H2、I2(HI),E装置浓硫酸的作用是 吸收多余的氨气;
(2)装置B中锌的作用是吸收碘蒸气,反应方程式:Zn+I2═ZnI2,故D装置的作用是作安全瓶,防倒吸,因为氨气极易被浓硫酸吸收;
(3)利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;
(4)Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;
(5)步骤4中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致、溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红;
(6)氧化物样品质量为7.84克,还原成铁粉质量为5.6克,氧元素质量为:7.84-5.6g=2.24g,则铁和氧的原子个数比为:![]() :
:![]() =0.1:0.14=5:7,氧化物的平均分子式为Fe5O7,由此确定混合物的组成。
=0.1:0.14=5:7,氧化物的平均分子式为Fe5O7,由此确定混合物的组成。
:(1)实验时中A有大量紫红色的烟气,说明生成了碘蒸气,NH4I发生下列反应:NH4I(固)NH3(气)+HI(气),2HI(气)H2(气)+I2(气),则NH4I的分解产物为 NH3、H2、I2(HI),E装置浓硫酸的作用是 吸收多余的氨气;
(2)装置B的作用是吸收碘蒸气,反应方程式:Zn+I2═ZnI2,因为氨气极易被浓硫酸吸收,故D装置的作用是作安全瓶,防倒吸;
(3)利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;
(4)利用甲组现象可知Fe2O3与CO在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O;
(5)因Fe3+遇SCN-显红色,所以乙组步骤3中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致,溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红;
(6)氧化物样品质量为7.84克,还原成铁粉质量为5.6克,氧元素质量为:7.84-5.6g=2.24g,则铁和氧的原子个数比为:![]() :
:![]() =0.1:0.14=5:7,氧化物的平均分子式为Fe5O7;则混合物的组成为Fe2O3和FeO或Fe2O3和Fe3O4,故答案为:Fe2O3和FeO或Fe2O3和Fe3O4。
=0.1:0.14=5:7,氧化物的平均分子式为Fe5O7;则混合物的组成为Fe2O3和FeO或Fe2O3和Fe3O4,故答案为:Fe2O3和FeO或Fe2O3和Fe3O4。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
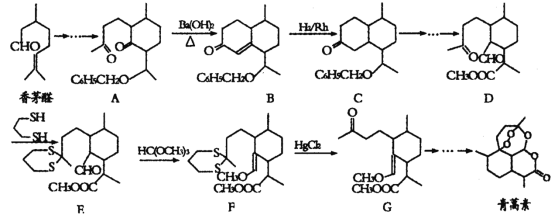
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中国医药科技创新和人类健康事业作出了巨大贡献,我国化学家在确认青蒿素分子结构后实现了青蒿素的全合成。一种以香茅醛为原料合成青蒿素的流程如图:
已知:羰基α—H可发生反应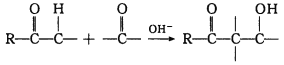
回答下列问题:
(1)青蒿素的分子式为__。根据青蒿素所含官能团,推测其可能具有的性质有___。
a.易溶于水 b.具有氧化性 c.可发生水解反应
(2)香茅醛的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有__种,其中核磁共振氢谱峰数最少的物质结构简式为__。
(3)反应A→B实际上可看作两步进行,依次发生的反应类型是__、__。
(4)C中所含官能团名称为__。
(5)通过D→E的反应,分子中引入了硫醚基团,而F→G的反应,分子中硫醚基团又被脱去,这样做的目的是__。
(6)写出由苯甲醛和氯乙烷为原料,制备苄基乙醛(![]() )的合成路线流程__(无机试剂任选)。
)的合成路线流程__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解饱和 NaCl 溶液的实验装置,x、y 都是惰性电极,a 是饱和 NaCl 溶液,同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是

A.x 电极为阳极,y 电极为阴极
B.x 电极附近溶液变红色,且有刺激性气味气体产生
C.若将两电极产生的气体收集起来,X电极得到的气体与Y电极得到的气体之比之比略大于 1:1
D.电解后,将溶液混匀,电解前后溶液的 pH 未发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其消毒后被还原为Fe(OH)3;又可以有净水的功能,是一种无二次污染的绿色水处理剂。工业上制备方法有:①湿法:次氯酸盐氧化法②干法:高温过氧化物法。
(1)湿法制备的主要反应方程为Fe(OH)3+KClO+KOH=K2FeO4+KCl+H2O,配平上述反应化学方程式___。
(2)干法制备中牵涉到的物质有:FeSO4、K2FeO4、K2SO4、K2O2,将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目___。
(3)制备相同质量 K2FeO4 时转移的电子数,湿法制备 ___干法制备(填“>” “<”或“=”)。
(4)高铁酸钾和二氧化氯(其还原产物为 Cl—)都是高效杀菌消毒剂,但消毒效率(单位质量转移的电子数)是不相同的,则高铁酸钾的效率是二氧化氯的___倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,将nmol·L-lCH3COOH溶液滴入10mL1.0mol·L-1NaOH溶液中,溶液pH和温度随加入CH3COOH溶液体积变化曲线如图所示,下列有关说法正确的是
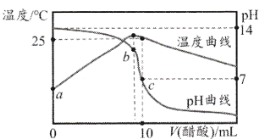
A. Kw:a>bB. 25℃时:K( CH3COOH)=1/(n-1) 10-7
C. n<1.0D. 水的电离程度:c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断键的说明不正确的
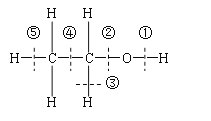
A.和金属钠反应是键①断裂
B.和浓氢溴酸混合加热时断键②
C.和浓硫酸共热到170℃时断键②和⑤
D.和浓硫酸共热到140℃时仅断键②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物X、Y的说法不正确的是( )
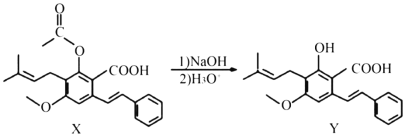
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙酸发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下,X、Y分别与足量Br2加成的产物分子中的手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
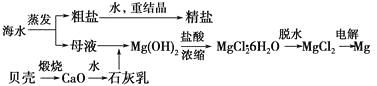
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个6L的密闭容器中,放入3LX(g)和2LY(g),在一定条件下发生下列反应:4X(g)+3Y(g)2Q(g)+nR(g)达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n的值是
A.3B.4C.5D.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com