
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其消毒后被还原为Fe(OH)3;又可以有净水的功能,是一种无二次污染的绿色水处理剂。工业上制备方法有:①湿法:次氯酸盐氧化法②干法:高温过氧化物法。
(1)湿法制备的主要反应方程为Fe(OH)3+KClO+KOH=K2FeO4+KCl+H2O,配平上述反应化学方程式___。
(2)干法制备中牵涉到的物质有:FeSO4、K2FeO4、K2SO4、K2O2,将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目___。
(3)制备相同质量 K2FeO4 时转移的电子数,湿法制备 ___干法制备(填“>” “<”或“=”)。
(4)高铁酸钾和二氧化氯(其还原产物为 Cl—)都是高效杀菌消毒剂,但消毒效率(单位质量转移的电子数)是不相同的,则高铁酸钾的效率是二氧化氯的___倍。
【答案】2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O ![]() < 0.2
< 0.2
【解析】
(1)在反应Fe(OH)3+NaClO+NaOH→Na2FeO4+NaCl+H2O中,铁从+3价升为+6价,氯从+1价降为-1价,根据电子得失守恒及元素守恒配平化学方程式;
(2)干法制备中制备高铁酸钠(Na2FeO4),故由FeSO4反应得到,铁元素化合价升高,需要氧化剂,据此分析;
(3)干法中发生反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=10mol,所以每生成1molNa2FeO4共转移5mol电子,湿法制备的过程中Fe(OH)3→Na2FeO4,所以每生成1molNa2FeO4共转移3mol电子;
(4)高铁酸钾和二氧化氯(ClO2)都是高效杀菌消毒剂,均表现氧化性,则消毒效率分别为:
K2FeO4~Fe3+~3e-
198g 3mol
1g![]() mol
mol
ClO2~Cl-~5e-
67.5g 5mol
1g ![]() mol,据此计算可得。
mol,据此计算可得。
(1)在反应Fe(OH)3+NaClO+NaOH→Na2FeO4+NaCl+H2O中,铁从+3价升为+6价,氯从+1价降为-1价,反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;
(2)干法制备中制备高铁酸钠(Na2FeO4),故由FeSO4反应得到,铁元素化合价升高,需要氧化剂,则为Na2O2,可得反应:2FeSO4+4Na2O2=2Na2FeO4+2Na2SO4,故作为反应物的物质为2FeSO4+4Na2O2,其中Fe2+失电子发生氧化反应,用单线桥标出电子转移的方向和数目为![]() ;
;
(3)干法中发生反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=10mol,所以每生成1molNa2FeO4共转移5mol电子,湿法制备的过程中Fe(OH)3→Na2FeO4,所以每生成1molNa2FeO4共转移3mol电子,所以制备相同质量Na2FeO4时转移的电子数,湿法制备<干法制备;
(4)高铁酸钾和二氧化氯(ClO2)都是高效杀菌消毒剂,均表现氧化性,则消毒效率分别为:
K2FeO4~Fe3+~3e-
198g 3mol
1g![]() mol
mol
ClO2~Cl-~5e-
67.5g 5mol
1g ![]() mol
mol
则高铁酸钾的效率是二氧化氯的![]() mol:
mol:![]() mol =0.2。
mol =0.2。


科目:高中化学 来源: 题型:
【题目】α—甲基苯乙烯(AMS)在有机合成中用途广泛,以下是用苯为原料合成AMS,并进一步制备香料龙葵醛的路线:
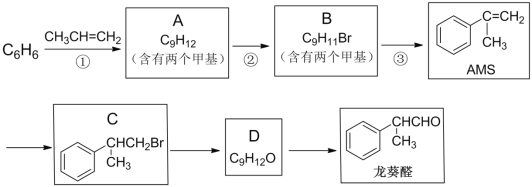
完成下列填空:
(1)反应①的反应类型是____;反应③所需的试剂与条件是____。
(2)写出反应②的化学方程式:____。
(3)AMS可以自身聚合,写出该高聚物的结构简式:____。
(4)写出同时满足下列条件的龙葵醛的一种同分异构体的结构简式:____。
i. 苯环上的一氯代物有两种
ii. 分子中没有甲基
iii. 能与金属钠产生H2
(5)有人认为仅用反应②就能得到C,事实证明产物中C的含量远远小于B。由该事实可以得到的结论是____。
(6)设计一条由AMS合成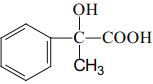 的合成路线____。(合成路线常用的表示方式为:A
的合成路线____。(合成路线常用的表示方式为:A ![]() B。。。
B。。。![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是________________。
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类,它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式_____________。
(4)C与D反应能生成相对分子质量为100的酯,其化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合下列各组物质使之充分反应,加热蒸干产物并在 300℃灼烧至质量不变,最终残留固体不是纯净物的是
A.向 Fe、FeO 和 Fe2O3 的混合物中加入过量的氯水
B.等物质的量浓度、等体积的(NH4)2SO4 与 BaCl2 溶液,
C.等物质的量的 NaHCO3 与 Na2O2 固体
D.在 NaBr 溶液中通入过量氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列关于铁元素及其化合物的知识:
(1)将 NaOH 溶液滴入 FeSO4溶液中,能观察到的现象是___,请写出产物颜色变化时发生的反应方程式___。
(2)实验室配制氯化铁溶液时,通常应将氯化铁固体溶解在加有少量 ___的水中; FeCl2溶液在空气中放置一段时间后,逐渐变成浅黄色,其原因是___。(用离子方程式表示)
(3)在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。该反应的化学方程式_________________,该反应中的还原剂是___,氧化剂是___。
(4)在 100mL18mol/L的浓硫酸中加入过量的铁片,加热使之充分反应,产生的气体在标准状况下的体积可能是 ___。
A.40.32L B.25.76L C.20.16L D.6.72L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,定容密闭容器中0.4mol/LN2,1mol/LH2进行反应:N2(g)+ 3H2(g)![]() 2NH3(g),10min反应达到平衡,此时测得N2浓度为0.2mol/L。
2NH3(g),10min反应达到平衡,此时测得N2浓度为0.2mol/L。
(1)10min内,用H2浓度变化来表示的反应速率为___,平衡时NH3的物质的量浓度为____;
(2)能判断该反应达到化学平衡状态的依据是____
A.容器中密度不随时间变化而变化 B.容器中各物质的浓度保持不变
C.N2和NH3的消耗速率之比为2∶1 D.N2消耗速率与H2生成速率之比为3:1
(3)平衡时N2和H2的转化率之比为____;该反应的平衡常数表达式为K=____,该温度下反应的平衡常数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究温度对氨气还原 Fe2O3 的影响(固定装置略)。完成下列填空:
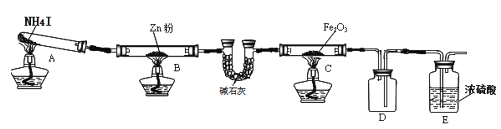
(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为 ___(至少填三种),E装置的作用是___。
(2)装置B中的反应方程式:______,D装置的作用是______。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(3)乙组得到的黑色粉末是______。
(4)甲组步骤1中反应的离子方程式为______。
(5)乙组步骤3中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将容积为50 mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5 mL。则原混合气体中NO2和O2体积比可能是________或________。
(2)工业制硫酸的过程中,SO2被氧气氧化的化学方程式为_____________________。
(3) 工业制漂白粉的化学方程式_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com