
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含 Mg2B2O5·H 2O、SiO2 及少量 Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:

已 知 :H3BO3+H2O![]() H++B(OH)
H++B(OH)![]() ,Ka = 5.81×10 10
,Ka = 5.81×10 10
(1)“吸收”过程中反应的化学方程式为_________________________________。
(2)“滤渣 1”的主要成分有_____。
(3)为检验“过滤 1”后的滤液中是否含有 Fe3+离子,可选用的化学试剂是____________________________。
(4)在“过滤 2”前,将溶液 pH 调节至 3.5,目的是_____。
(5)在“沉镁”中生成 Mg(OH)2·MgCO3 沉淀的离子方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其消毒后被还原为Fe(OH)3;又可以有净水的功能,是一种无二次污染的绿色水处理剂。工业上制备方法有:①湿法:次氯酸盐氧化法②干法:高温过氧化物法。
(1)湿法制备的主要反应方程为Fe(OH)3+KClO+KOH=K2FeO4+KCl+H2O,配平上述反应化学方程式___。
(2)干法制备中牵涉到的物质有:FeSO4、K2FeO4、K2SO4、K2O2,将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目___。
(3)制备相同质量 K2FeO4 时转移的电子数,湿法制备 ___干法制备(填“>” “<”或“=”)。
(4)高铁酸钾和二氧化氯(其还原产物为 Cl—)都是高效杀菌消毒剂,但消毒效率(单位质量转移的电子数)是不相同的,则高铁酸钾的效率是二氧化氯的___倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子结构中各种化学键如图所示,关于乙醇在各种反应中断键的说明不正确的
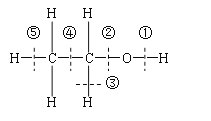
A.和金属钠反应是键①断裂
B.和浓氢溴酸混合加热时断键②
C.和浓硫酸共热到170℃时断键②和⑤
D.和浓硫酸共热到140℃时仅断键②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物X、Y的说法不正确的是( )
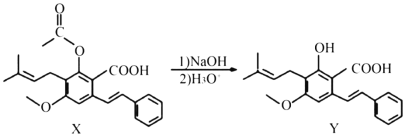
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙酸发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下,X、Y分别与足量Br2加成的产物分子中的手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2+7O2![]() 2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4
2MoO3+4SO2;②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;④H2MoO4![]() MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
A. MoS2煅烧产生的尾气可直接排空
B. MoO3是金属氧化物,也是碱性氧化物
C. H2MoO4是一种强酸
D. 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
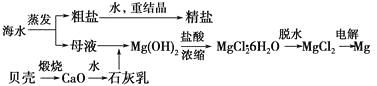
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10min内,用H2O(g)表示的化学反应速率v(H20)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________。
③在其它条件不变的情况下,若30min时改变温度为T
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,40 g、10%硝酸钠溶液与60 g、7.5%的硝酸钠溶液混合,得到密度为1.20 g·cm-3的混合溶液,计算:
(1)该混合溶液中溶质的质量分数为__;
(2)该混合溶液中NaNO3的物质的量浓度为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com