
【题目】已知 K2FeO4 溶于水后,会水解生成多种微粒。下图是0.10 mol·L1 K2FeO4 溶液中各含铁微粒随溶液 pH 的变化图,纵坐标表示其个数百分含量,则下列说法不正确的是
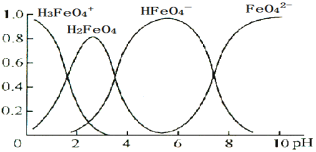
A.K2FeO4 溶于水呈碱性B.![]() 水解强于电离
水解强于电离
C.H2FeO4 既能和强碱反应又能和强酸反应D.0.10 mol·L1 的 K2FeO4 的 pH 近似等于 10
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有下列两种转化途径,某些反应条件和产物已省略。下列有关说法不正确的是
途径① S![]() H2SO4
H2SO4
途径② S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①反应中体现了浓硝酸的强氧化性和酸性
B. 途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C. 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D. 途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法制备1-溴丁烷,还会有烯、醚和溴等产物生成,反应结束后将反应混合物蒸馏分离得到1-溴丁烷。已知有关物质的性质如下:
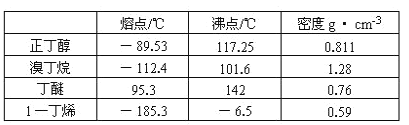

(1)生成1-溴丁烷的反应化学方程式为_____。
(2)反应中由于发生副反应而生成副产物烯、醚的反应类型依次为_____、_____。
(3)生成1-溴丁烷的反应装置应选用图中的______(填序号),反应加热时的温度t1应控制在_____100℃(填“ ”或“”)。
(4)反应结束后,将反应混合物中 l-溴丁烷分离出来,应选用的装置是_____,该操作应控制的温度t2范围是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物说法,不正确的是
A.“雷雨发庄稼”是由于放电条件有利于游离态的氮转化为化合态
B.二氧化氮不仅能形成酸雨,还能在一定条件下促进形成“光化学烟雾”
C.铵态氮肥应保存在阴凉处,硝态氮肥(硝酸盐)则能够耐高温
D.工业上制备硝酸过程中,氨催化氧化放出大量热,能预热新进入设备的氨气和空气,节约能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 == 2Na2CO3 + O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和过氧化钠为原料,制取O2,设计出如下实验装置:

(1)A中制取CO2 的装置,应从下列图①、② 中选哪个图:________。

A装置中发生反应的离子方程式为 ______________________________。
(2)B装置的作用是________________,C装置内可能出现的现象是__________ 。为了检验E中收集到的气体,在取出集气瓶后,__________________________(简要表述操作过程及结论)。
(3)若E中的石灰水出现轻微白色浑浊,请说明原因:_______________ (用离子方程式及简要文字描述)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气还原 NO 的反应为![]() 。
。
(1)![]() 的电子式为________。
的电子式为________。
(2)已知几种共价键的键能如下:
共价键 | H-H |
| N-O | H-O |
键能/( | 436 | 946 |
| 464 |
根据上述数据计算,NO的键能![]() =___________。
=___________。
(3)![]() 的反应速率表达式为
的反应速率表达式为![]() (
(![]() 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。![]() 和
和![]() 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、![]() 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
序号 |
|
|
|
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.10 | 0.20 | 0.828 |
Ⅲ | 0.30 | 0.10 | 3.726 |
①![]() 中,
中,![]() =____,
=____,![]() =______。
=______。
②经研究,有人提出上述反应分两步进行:![]() ;
;![]() 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能________(填“大于”“小于”或“等于”)(b)正反应活化能。
③1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:![]() [
[![]() 为反应速率常数,
为反应速率常数,![]() 为比例常数,
为比例常数,![]() 为自然对数的底数,
为自然对数的底数,![]() 为气体摩尔常数,
为气体摩尔常数,![]() 为开尔文温度,
为开尔文温度,![]() 为活化能
为活化能![]() ]。
]。![]() 反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
反应达到平衡后,升高温度,正反应速率常数增大的倍数_____(填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
(4)一定温度下,在2 L恒容密闭容器中充入2 mol NO(g)、![]() 发生上述反应,混合气体压强随着时间变化关系如图所示。
发生上述反应,混合气体压强随着时间变化关系如图所示。
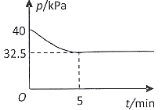
①05 min 内![]() 的平均速率
的平均速率 ![]() =___________________
=___________________![]() 。
。
②该温度下,上述反应的平衡常数![]() =________________
=________________![]() 。
。
③其他条件不变,在10min时向反应体系中再充入1mol NO、![]() ,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
,达到新平衡时NO的平衡转化率 ________________(填“增大”“减小”或“不变”)。
(5)工业上,可以采用电化学方法处理NO。以惰性材料为电极,以硝酸铵溶液为电解质溶液并补充![]() ,电解反应为
,电解反应为![]() 。电解过程中,阳极的电极反应式为_______________________。
。电解过程中,阳极的电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示。下列叙述正确的是
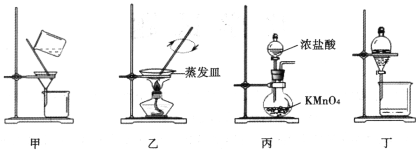
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag
C.用装置丙制备Cl2,其中KMnO4也可用MnO2代替
D.用装置丁分液时,打开分液漏斗塞子,再打开旋塞,使下层液体从分液漏斗下端放出,待两液界面与旋塞上口相切即可关闭旋塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:mCeO2 (m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2
(m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

下列说法不正确的是( )
A.该过程中CeO2没有消耗B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3D.H2(g)+O2(g)=H2O(g)的反应热大于ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com