
����Ŀ��ʵ�������ü������������廯�ƺ�Ũ����Ļ����ķ����Ʊ�1-�嶡�飬������ϩ���Ѻ���Ȳ������ɣ���Ӧ������Ӧ������������õ�1-�嶡�顣��֪�й����ʵ��������£�
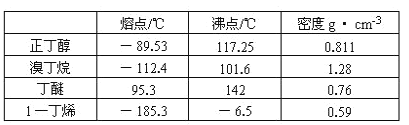

��1������1���嶡��ķ�Ӧ��ѧ����ʽΪ_____��
��2����Ӧ�����ڷ�������Ӧ�����ɸ�����ϩ���ѵķ�Ӧ��������Ϊ_____��_____��
��3������1���嶡��ķ�Ӧװ��Ӧѡ��ͼ�е�______(�����)����Ӧ����ʱ���¶�t1Ӧ������_____100��(���� ��������)��
��4����Ӧ��������Ӧ������� l���嶡����������Ӧѡ�õ�װ����_____���ò���Ӧ���Ƶ��¶�t2��Χ��_____��
���𰸡�CH3CH2CH2CH2OH+NaBr+H2SO4(Ũ)![]() CH3CH2CH2CH2Br+NaHSO4+H2O ��ȥ ȡ�� C D 101.6�桫117.25��
CH3CH2CH2CH2Br+NaHSO4+H2O ��ȥ ȡ�� C D 101.6�桫117.25��
��������
��1��ʵ�������ü������������廯�ƺ�Ũ����Ļ��������1-�嶡�顢�������ƺ�ˮ���ݴ���д��ѧ����ʽ��
��2����������Ũ�����ڼ��������¿��Է�����ȥ��Ӧ������1-��ϩ��Ҳ���Է���ȡ����Ӧ���ɶ����ѵȣ�
��3��ʵ�����ü���1-�������廯�ƺ�ŨH2SO4�Ļ����ķ������Ʊ�1-�嶡��ʱ��������Ӧ���ɲ����к���������ˮ���廯�⣬������ϩ���ѵȸ��������ɣ�����װ����Ҫ������������1-�嶡��е�101.6���з�����
��4������Ӧ�������1-�嶡�鼰ʱ�����������������ķ���������ʱҪʹ1-�嶡��������ȥ���������������������������ṩ�ĸ����ʵķе��֪���Ƶ��¶�t2��Χ��
��1��ʵ�������ü������������廯�ƺ�Ũ����Ļ��������1-�嶡�顢�������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��CH3CH2CH2CH2OH+NaBr+H2SO4(Ũ)![]() CH3CH2CH2CH2Br+NaHSO4+H2O��
CH3CH2CH2CH2Br+NaHSO4+H2O��
��2����������Ũ�����ڼ��������¿��Է�����ȥ��Ӧ������1-��ϩCH3CH2CH=CH2��Ҳ���Է���ȡ����Ӧ���ɶ����ѵȣ�CH3CH2CH2CH2OCH2CH2CH2CH3��
��3��ʵ�����ü���1-�������廯�ƺ�ŨH2SO4�Ļ����ķ������Ʊ�1-�嶡��ʱ��������Ӧ���ɲ����к���������ˮ���廯�⣬������ϩ���ѵȸ��������ɣ�����װ����Ҫ�����������Ʊ�1-�嶡���װ��Ӧѡ����ͼ��C��1-�嶡��е�101.6����Ӧ����ʱ���¶Ȳ��˳���100�棬��ֹ1-�嶡�����������ݳ���Ӱ����ʣ��Ϻõļ��ȷ���Ϊˮԡ���ȣ���ʹ�¶Ⱥ㶨��
��4�����÷е㲻ͬ����Һ������ķ�������������װ���е�D�������������õ�1-�嶡�飬��ˮԡ���ȴﲻ���¶�Ҫ��ѡ����ԡ���ȣ��¶�Ӧ������101.6���t��117.25�档


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA(g)��B(g) ![]() C(g)��D(g)��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.20 mol A��0.20 mol B,10 sʱ��ƽ�⡣����˵������ȷ����
C(g)��D(g)��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.20 mol A��0.20 mol B,10 sʱ��ƽ�⡣����˵������ȷ����
�¶�/�� | 700 | 830 | 1200 |
Kֵ | 1.7 | 1.0 | 0.4 |
A. �ﵽƽ���B��ת����Ϊ50%
B. ����ѹǿ�������淴Ӧ���ʾ��ӿ�
C. �÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�
D. ��Ӧ��ʼ��ƽ�⣬A��ƽ����Ӧ����v(A)��0.005 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯����������ת����ϵ
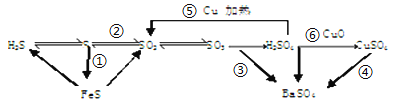
(1)����������ԭ��Ӧ����___________(�����)
(2)д��(5)�ķ�Ӧ����ʽ____________��˵��Ũ�������___________����ȡCuSO4��__________�������(�����)��
(3)SO2����ɿ�����Ⱦ���γ��������Ҫ���ʡ�SO2��ˮ�Ĵ�������������Ӧ�������ᣬ��Ӧ����ʽΪ_____________����֤��������ķ�����_____________��
(4)ij��Һ�к���Cl-��SO42-�����ܺ���Na+��Fe2+������һ�֡�
����֤Cl-��SO42-�ķ�����______________
A.�ȼ�BaCl2��Һ���ȳ������ټ�AgNO3��Һ
B.�ȼ�AgNO3��Һ���ȳ������ټ�BaCl2��Һ
C.�ȼ�Ba(NO3)2��Һ���ȳ������ټ�AgNO3��Һ
����֤Na+��Fe2+��ķ�����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�����Ԫ��A��B��C��D��AԪ��M������2�ԳɶԵ��ӣ�D��A�����ڱ���ͬһ���塣��A��B��D��ɵĻ������Ũ��Һ�dz����ĸ������������C����Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��ԣ���һ����Ҫ���ϡ�
��1��A��ԭ������㹲��___�ֲ�ͬ�˶�״̬�ĵ��ӣ���ԭ�ӹ���___�ֲ�ͬ�����ĵ��ӣ�������ߵĵ���ռ��___����������������״Ϊ____��
��2��Ԫ��A��B��D��ɵĻ������Ũ��Һ�dz�����������û�������ʵ�����Ʊ���������ʱ��������ã�_____��
��3��B��CԪ���γɴ�һ����λ����ɵ����ӣ�д�������ĵ���ʽ____��
��4��Ԫ��A��Ԫ��D��ȣ��ǽ����Խ�ǿ����____(��Ԫ�ط��ű�ʾ)�����б������ܱ�����һ��ʵ����____��
�ٱȽ�����������Ӧˮ���������
�ڱȽ϶�Ӧ��̬�⻯����ȶ���
��һ��������D�ܴ�A���⻯��ˮ��Һ���û���A����
��A���ʵ��۷е����Ը���D����
��ԭ�ӽṹ����A��D�ǽ���ǿ����ԭ��_____��
��5��Cԭ�ӵ�ԭ�ӽṹʾ��ͼ��_____��C���⻯���̬ʱ����____���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�SOC12�������Ȼ����������۵�һ105�棬�е�79�棬140������ʱ�ֽ⡣��һ����ɫ��ɫ����Һ�壬��ˮ������ˮ��Ӧ����SO2����һ�������壬��������ˮ�����㷺Ӧ����ҽҩ��ũҩ�����Ϲ�ҵ���л��ϳɹ�ҵ��
��1���Ȼ��������������������ͨ�����õĿⷿ�������ú��Ի�ɫ����ԭ����___������ơ�Һ�Ⱥ���������Ϊԭ����һ�������ɺϳ��Ȼ������������ﵽԭ����������������ߵ����ʵ���֮��Ϊ___��
��2��ʵ���Һϳ�SOCl2��ԭ��֮һΪSO2+Cl2+SCl2![]() 2SOCl2������װ����ͼ��ʾ��
2SOCl2������װ����ͼ��ʾ��
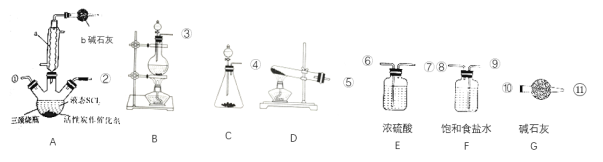
��װ��b��������___��
��ʵ������ȡSOCl2��ѡ����������˳����___��
��3����ͬѧ�����ͼװ����ZnCl2��xH2O������ȡ��ˮZnCl2������ʣ���SOCl2����֤�������к���SO2(�гּ�����װ����)��ѡ��װ����ͼ��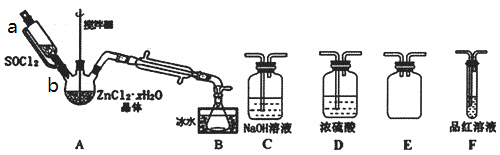
��������A�л����μ�SOCl2�������___���a������b����a��b������
��Ϊ�˸��ӳ�ֵĻ���SOCl2��д���ɶ�װ��B��ȡ����Ч��ʩ___��
��4����ͬѧ��Ϊ���ã�3����װ�ã���FeCl3��6H2O��ȡ��ˮFeCl3Ҳ����SOCl2����ˮ��������ͬѧ��Ϊ�ᷢ��������ԭ��Ӧ����������ˮFeCl3����ͬѧ���������ʵ�鷽����֤�Լ��Ĺ۵㣺
ȡ����FeCl3��6H2O���Թ��У��������SOCl2����ʹ�������ʳ�ַ�Ӧ�������Թ��м�ˮ�ܽ⣬����___��֤���ù��̷�����������ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��Kw=1.0��10-12�����ڸ��¶�ʱ��ij��Һ��c��H+��=1.0��10-7molL-1�������Һ
A. ������ B. �ʼ��� C. ������ D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£�������������Һ��
��0.1mol/LNH4Cl��0.1mol/LCH3COONH4��0.1mol/LNH4HSO4
��0.1mol/LNH4HCO3 ��0.1mol/LNaHCO3
�����Ҫ����д���пհף�
��1����Һ�ٳ� ______ �ԣ���ᡱ��������С�������ԭ���ǣ� ______ �������ӷ���ʽ��ʾ��
��2����Һ�ݳ� ______ �ԣ���ᡱ��������С�������ԭ���ǣ� ______ �������ӷ���ʽ��ʾ��
��3���Ƚ���Һ�١�����c��NH4+���Ĵ�С��ϵ�Ǣ� ______ �ۣ����������������=����
��4�������£������Һ�ڵ�pH=7����CH3COO-��ˮ��̶� ______ NH4+��ˮ��̶ȣ����������������=������CH3COO-��NH4+Ũ�ȵĴ�С��ϵ�ǣ�c��CH3COO-��_____c��NH4+�������������������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ K2FeO4 ����ˮ��ˮ�����ɶ���������ͼ��0.10 mol��L1 K2FeO4 ��Һ�и�����������Һ pH �ı仯ͼ���������ʾ������ٷֺ�����������˵������ȷ����
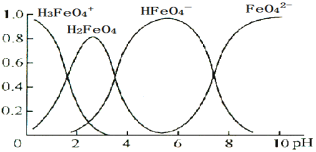
A.K2FeO4 ����ˮ�ʼ���B.![]() ˮ��ǿ�ڵ���
ˮ��ǿ�ڵ���
C.H2FeO4 ���ܺ�ǿ�Ӧ���ܺ�ǿ�ᷴӦD.0.10 mol��L1 �� K2FeO4 �� pH ���Ƶ��� 10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�Լ״�Ϊԭ����ȡ�ߴ�H2������Ҫ��Ӧ�ü�ֵ���״�ˮ��������������Ҫ��������������Ӧ��
����Ӧ��![]() H=+49kJmol-1
H=+49kJmol-1
����Ӧ��![]() H=+41kJmol-1
H=+41kJmol-1
���״������ڴ����������ѽ�ɵõ�H2��CO����÷�Ӧ���Ȼ�ѧ����ʽΪ_________________�����ܼӿ췴Ӧ�����������CH3OHƽ��ת���ʵ�һ�ִ�ʩ��______________��
�������ʵ�����ˮ����![]() �Լ״�ˮ������������ĺô���__________��
�Լ״�ˮ������������ĺô���__________��
��ij�¶��£���n(H2O)��n(CH3OH)=1��1��ԭ������������ܱ������У���ʼѹǿΪP1����Ӧ��ƽ��ʱ��ѹǿΪP2����ƽ��ʱ�״���ת����Ϊ________________(���Ը���Ӧ���ú�P1��P2��ʽ�ӱ�ʾ)��
(2)��ҵ����CH4��ˮ������һ����������ȡH2��ԭ��Ϊ��![]() H=+203kJmol-1
H=+203kJmol-1
���÷�Ӧ�淴Ӧ���ʱ���ʽΪ��v��=k��c(CO)��c3(H2)��kΪ���ʳ�������ij�¶��²��ʵ���������±���
c(CO)/mol��L��1 | c(H2)/mol��L��1 | v��/mol��L��1��min��1 |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
���������ݿɵø��¶��£��÷�Ӧ���淴Ӧ���ʳ���kΪ_________L3��mol��3��min��1��
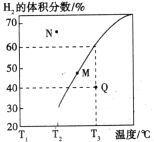
�������Ϊ3L���ܱ�������ͨ�����ʵ�����Ϊ3mol��CH4��ˮ��������һ�������·���������Ӧ�����ƽ��ʱH2������������¶ȹ�ϵ��ͼ��ʾ��N��v��____________M��v��(��������������С����)��Q���Ӧ�¶��¸÷�Ӧ��ƽ�ⳣ��K=_______________mol2��L��2��ƽ������������м���1molCH4��1molCO��ƽ����_____________�����ƶ�(��������Ӧ�������淴Ӧ��)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com