
【题目】现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要肥料。
(1)A的原子最外层共有___种不同运动状态的电子,该原子共有___种不同能量的电子,能量最高的电子占有___个轨道,其电子云形状为____。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,该化合物在实验室制备乙酸乙酯时所起的作用:_____。
(3)B与C元素形成带一个单位正电荷的离子,写出该微粒的电子式____。
(4)元素A与元素D相比,非金属性较强的是____(用元素符号表示),下列表述中能表明这一事实的是____。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
从原子结构分析A和D非金属强弱的原因_____。
(5)C原子的原子结构示意图:_____,C的氢化物固态时属于____晶体。
【答案】6 5 3 哑铃形 催化剂、吸水剂 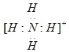 O ②③ 硫原子和氧原子最外层电子数相同,但硫原子比氧原子多一个电子层,半径较大,对外层电子的吸引力弱,故非金属性较弱
O ②③ 硫原子和氧原子最外层电子数相同,但硫原子比氧原子多一个电子层,半径较大,对外层电子的吸引力弱,故非金属性较弱  分子
分子
【解析】
现有短周期元素A、B、C、D,A元素M层上有2对成对电子,A的M层含有6个电子,为S元素;D与A在周期表中同一主族,则D为O元素;由A、B与D组成的化合物的浓溶液是常见的干燥剂,该干燥剂为浓硫酸,则B为H元素;常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料,则C为N元素。
(1)A为S原子,其最外层含有6个电子,则最外层共有6种不同运动状态的电子;S有1s、2s、2p、3s、3p共有5种不同能量的电子,能量最高的电子在3p能级,占有3个轨道,其电子云形状为哑铃形。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,该干燥剂为浓H2SO4,该化合物在实验室制备乙酸乙酯时所起的作用:催化剂、吸水剂;。
(3)B与C元素形成带一个单位正电荷的离子为铵根离子,铵根离子是阳离子,电子式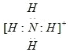 。
。
(4)元素A与元素D相比,即元素S与元素O相比,位于同一主族,原子序数越大,非金属性越弱,非金属性较强的是O;
①比较最高价氧化物对应水化物的酸性,但O元素没有含氧酸,无法据此判断非金属性强弱,故①错误;
②比较对应气态氢化物的稳定性,氢化物稳定性越强,非金属性越强,通过比较对应气态氢化物的稳定性,可以判断二者非金属性强弱,故②正确;
③一定条件下氧气能从硫化氢的水溶液中置换出S单质,证明O的非金属性大于S,故③正确;
④沸点大小与非金属性没有必然关系,无法根据沸点高低判断非金属性强弱,故④错误;
故选②③;
A和D非金属强弱的原因:硫原子和氧原子最外层电子数相同,但硫原子比氧原子多一个电子层,半径较大,对外层电子的吸引力弱,故非金属性较弱;
(5)N原子的原子结构示意图: ,C为N元素,其氢化物为氨气,氨气在固态时属于分子晶体。
,C为N元素,其氢化物为氨气,氨气在固态时属于分子晶体。


科目:高中化学 来源: 题型:
【题目】完成下列小题。
(1)某有机物X含有C、H元素,可能含有O元素。取0.46g X在氧气中完全燃烧,将燃烧后的产物依次通过浓硫酸和碱石灰,测得浓硫酸增重0.54g,碱石灰增重0.88g。由实验分析计算可得X的____(填“实验式”、“分子式”或“结构简式”)为____。
(2)有机物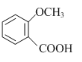 含有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:____。①能发生银镜反应;②与FeCl3发生显色反应;③苯环上的一元取代物只有1种
含有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:____。①能发生银镜反应;②与FeCl3发生显色反应;③苯环上的一元取代物只有1种
(3)化合物D是合成神经保护剂依那朵林的中间体,合成路线如下:
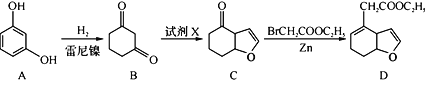
请写出以![]() 和BrCH2COOC2H5为原料制备
和BrCH2COOC2H5为原料制备![]() 的合成路线流程图(无机试剂任用。合成示例例见本题题干)____。
的合成路线流程图(无机试剂任用。合成示例例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列两种转化途径,某些反应条件和产物已省略。下列有关说法不正确的是
途径① S![]() H2SO4
H2SO4
途径② S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
A. 途径①反应中体现了浓硝酸的强氧化性和酸性
B. 途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C. 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D. 途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置制取氯气,并收集氯气进行实验。
请完成下列问题:
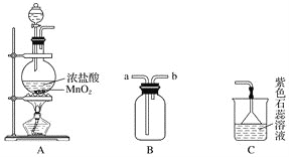
(1)装置A中发生反应的离子方程式为______________________________________。
(2)装置B如图中所示正放,则连接A的接口是________(填序号)。
(3)实验中可观察到装置C中紫色石蕊溶液的现象是__________________,其原因______________________________________________________________________。
(4)取出B中的集气瓶进行氯气与铜的反应实验,应该进行的操作是______________,然后立刻放入充满氯气的集气瓶中。实验中有同学提出应该在集气瓶底先放少量的水或细沙,你认为__________(填“需要”或“不需要”)放,理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.46gNO2和N2O4混合气体中所含的原子总数为3NA
B.反应4FeS2+11O2![]() 2Fe2O3+8SO2每生成2molFe2O3转移电子总数为44NA
2Fe2O3+8SO2每生成2molFe2O3转移电子总数为44NA
C.22.4L的N2和O2所含的分子总数为NA,该混合气体所处的状况为标准状况
D.含1molFeCl3的饱和溶液滴加到沸水中,所得氢氧化铁胶体分散质的粒子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硝酸具有强氧化性。
①把铜粉和铁粉混合物加入热的浓硝酸中,充分反应后,溶液中有铜剩余,则溶液中存在的金属阳离子为___。
②某稀硫酸与稀硝酸的混合溶液中,c(SO42-)+c(NO3-)=3.0mol·L-1。取200mL该混合酸,能溶解铜的最大质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用加热正丁醇、溴化钠和浓硫酸的混合物的方法制备1-溴丁烷,还会有烯、醚和溴等产物生成,反应结束后将反应混合物蒸馏分离得到1-溴丁烷。已知有关物质的性质如下:
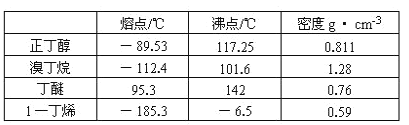

(1)生成1-溴丁烷的反应化学方程式为_____。
(2)反应中由于发生副反应而生成副产物烯、醚的反应类型依次为_____、_____。
(3)生成1-溴丁烷的反应装置应选用图中的______(填序号),反应加热时的温度t1应控制在_____100℃(填“ ”或“”)。
(4)反应结束后,将反应混合物中 l-溴丁烷分离出来,应选用的装置是_____,该操作应控制的温度t2范围是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物说法,不正确的是
A.“雷雨发庄稼”是由于放电条件有利于游离态的氮转化为化合态
B.二氧化氮不仅能形成酸雨,还能在一定条件下促进形成“光化学烟雾”
C.铵态氮肥应保存在阴凉处,硝态氮肥(硝酸盐)则能够耐高温
D.工业上制备硝酸过程中,氨催化氧化放出大量热,能预热新进入设备的氨气和空气,节约能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示。下列叙述正确的是
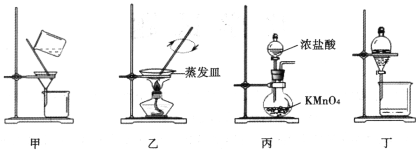
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag
C.用装置丙制备Cl2,其中KMnO4也可用MnO2代替
D.用装置丁分液时,打开分液漏斗塞子,再打开旋塞,使下层液体从分液漏斗下端放出,待两液界面与旋塞上口相切即可关闭旋塞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com