
ЁОЬтФПЁПЭъГЩЯТСааЁЬтЁЃ
ЃЈ1ЃЉФГгаЛњЮяXКЌгаCЁЂHдЊЫиЃЌПЩФмКЌгаOдЊЫиЁЃШЁ0.46g XдкбѕЦјжаЭъШЋШМЩеЃЌНЋШМЩеКѓЕФВњЮявРДЮЭЈЙ§ХЈСђЫсКЭМюЪЏЛвЃЌВтЕУХЈСђЫсдіжи0.54gЃЌМюЪЏЛвдіжи0.88gЁЃгЩЪЕбщЗжЮіМЦЫуПЩЕУXЕФ____ЃЈЬюЁАЪЕбщЪНЁБЁЂЁАЗжзгЪНЁБЛђЁАНсЙЙМђЪНЁБЃЉЮЊ____ЁЃ
ЃЈ2ЃЉгаЛњЮя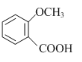 КЌгаЖржжЭЌЗжвьЙЙЬхЃЌаДГіЭЌЪБТњзуЯТСаЬѕМўЕФвЛжжЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЃК____ЁЃЂйФмЗЂЩњвјОЕЗДгІЃЛЂкгыFeCl3ЗЂЩњЯдЩЋЗДгІЃЛЂлБНЛЗЩЯЕФвЛдЊШЁДњЮяжЛга1жж
КЌгаЖржжЭЌЗжвьЙЙЬхЃЌаДГіЭЌЪБТњзуЯТСаЬѕМўЕФвЛжжЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЃК____ЁЃЂйФмЗЂЩњвјОЕЗДгІЃЛЂкгыFeCl3ЗЂЩњЯдЩЋЗДгІЃЛЂлБНЛЗЩЯЕФвЛдЊШЁДњЮяжЛга1жж
ЃЈ3ЃЉЛЏКЯЮяDЪЧКЯГЩЩёОБЃЛЄМСвРФЧЖфСжЕФжаМфЬхЃЌКЯГЩТЗЯпШчЯТЃК
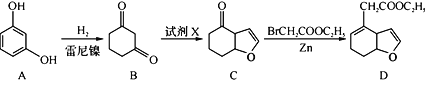
ЧыаДГівд![]() КЭBrCH2COOC2H5ЮЊдСЯжЦБИ
КЭBrCH2COOC2H5ЮЊдСЯжЦБИ![]() ЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮгУЁЃКЯГЩЪОЧЧ̞БОЬтЬтИЩЃЉ____ЁЃ
ЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮгУЁЃКЯГЩЪОЧЧ̞БОЬтЬтИЩЃЉ____ЁЃ
ЁОД№АИЁПЗжзгЪН C2H6O  Лђ
Лђ
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
ЁОНтЮіЁП
ЃЈ1ЃЉШМЩеКѓЕФВњЮяЮЊЖўбѕЛЏЬМКЭЫЎЃЌвРДЮЭЈЙ§ХЈСђЫсКЭМюЪЏЛвЃЌВтЕУХЈСђЫсдіжи0.54gЃЌМюЪЏЛвдіжи0.88gЃЌдђЫЎЕФжЪСПЮЊ0.54gЃЌЖўбѕЛЏЬМЕФжЪСПЮЊ0.88gЃЌИљОндЊЫиЪиКуНјааМЦЫуЃЛ
ЃЈ2ЃЉгаЛњЮя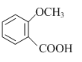 КЌгаЖржжЭЌЗжвьЙЙЬхЃЌЭЌЪБТњзуЯТСаЬѕМўЃКЂйФмЗЂЩњвјОЕЗДгІЃЌгІгаШЉЛљЃЛЂкгыFeCl3ЗЂЩњЯдЩЋЗДгІЃЌгІгаЗгєЧЛљЃЛЂлБНЛЗЩЯЕФвЛдЊШЁДњЮяжЛга1жжЃЛ
КЌгаЖржжЭЌЗжвьЙЙЬхЃЌЭЌЪБТњзуЯТСаЬѕМўЃКЂйФмЗЂЩњвјОЕЗДгІЃЌгІгаШЉЛљЃЛЂкгыFeCl3ЗЂЩњЯдЩЋЗДгІЃЌгІгаЗгєЧЛљЃЛЂлБНЛЗЩЯЕФвЛдЊШЁДњЮяжЛга1жжЃЛ
ЃЈ3ЃЉНсКЯвбжЊЗДгІвдМАЫљбЇЗДгІРраЭНјааЗжЮіЪщаДЁЃ
ЃЈ1ЃЉШМЩеКѓЕФВњЮяЮЊЖўбѕЛЏЬМКЭЫЎЃЌвРДЮЭЈЙ§ХЈСђЫсКЭМюЪЏЛвЃЌВтЕУХЈСђЫсдіжи0.54gЃЌМюЪЏЛвдіжи0.88gЃЌдђЫЎЕФжЪСПЮЊ0.54gЃЌЖўбѕЛЏЬМЕФжЪСПЮЊ0.88gЃЌдђИУгаЛњЮяXжаHдЊЫиЮяжЪЕФСПЮЊЃК![]() ЃЌCдЊЫиЮяжЪЕФСПЮЊЃК
ЃЌCдЊЫиЮяжЪЕФСПЮЊЃК![]() ЃЌHЁЂCдЊЫиЕФзмжЪСПЮЊЃК0.06molЁС1g/mol+0.02molЁС12g/mol=0.3gЃЌдђИУгаЛњЮяXжаКЌгаOдЊЫиЃЌ
ЃЌHЁЂCдЊЫиЕФзмжЪСПЮЊЃК0.06molЁС1g/mol+0.02molЁС12g/mol=0.3gЃЌдђИУгаЛњЮяXжаКЌгаOдЊЫиЃЌ![]() ЃЌдђПЩЕУЕНИУгаЛњЮяXЕФЪЕбщЪНЮЊC2H6OЃЌгЩгкИУЪЕбщЪНжаЧтдзгЪ§вбДяБЅКЭЃЌЙЪИУЪЕбщЪНОЭЪЧИУгаЛњЮяЕФЗжзгЪНЃЛЙЪД№АИЮЊЃКЗжзгЪНЃЛC2H6OЃЛ
ЃЌдђПЩЕУЕНИУгаЛњЮяXЕФЪЕбщЪНЮЊC2H6OЃЌгЩгкИУЪЕбщЪНжаЧтдзгЪ§вбДяБЅКЭЃЌЙЪИУЪЕбщЪНОЭЪЧИУгаЛњЮяЕФЗжзгЪНЃЛЙЪД№АИЮЊЃКЗжзгЪНЃЛC2H6OЃЛ
ЃЈ2ЃЉгаЛњЮя КЌгаЖржжЭЌЗжвьЙЙЬхЃЌЭЌЪБТњзуЯТСаЬѕМўЃКЂйФмЗЂЩњвјОЕЗДгІЃЌгІгаШЉЛљЃЛЂкгыFeCl3ЗЂЩњЯдЩЋЗДгІЃЌгІгаЗгєЧЛљЃЛЂлБНЛЗЩЯЕФвЛдЊШЁДњЮяжЛга1жжЃЌдђБНЛЗЩЯжЛгавЛжжЧтЃЌЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНга
КЌгаЖржжЭЌЗжвьЙЙЬхЃЌЭЌЪБТњзуЯТСаЬѕМўЃКЂйФмЗЂЩњвјОЕЗДгІЃЌгІгаШЉЛљЃЛЂкгыFeCl3ЗЂЩњЯдЩЋЗДгІЃЌгІгаЗгєЧЛљЃЛЂлБНЛЗЩЯЕФвЛдЊШЁДњЮяжЛга1жжЃЌдђБНЛЗЩЯжЛгавЛжжЧтЃЌЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНга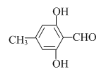 Лђ
Лђ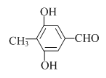 ЃЛЙЪД№АИЮЊЃК
ЃЛЙЪД№АИЮЊЃК Лђ
Лђ ЃЛ
ЃЛ
ЃЈ3ЃЉвд![]() КЭBrCH2COOC2H5ЮЊдСЯжЦБИ
КЭBrCH2COOC2H5ЮЊдСЯжЦБИ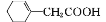 ЃЌгЩЬтИЩCЁњDЕФаХЯЂПЩжЊЃЌвЊКЯГЩ
ЃЌгЩЬтИЩCЁњDЕФаХЯЂПЩжЊЃЌвЊКЯГЩ![]() ЃЌПЩгЩ
ЃЌПЩгЩ![]() гыBrCH2COOC2H5ЗДгІЯШЩњГЩ
гыBrCH2COOC2H5ЗДгІЯШЩњГЩ![]() ЃЌ
ЃЌ![]() дкЫсадЛЗОГЯТЫЎНтЕУЕН
дкЫсадЛЗОГЯТЫЎНтЕУЕН![]() ЃЌЖј
ЃЌЖј![]() ПЩгЩ
ПЩгЩ![]() гыЫЎЯШЗЂЩњМгГЩЗДгІЩњГЩ
гыЫЎЯШЗЂЩњМгГЩЗДгІЩњГЩ![]() ЃЌ
ЃЌ![]() дйЗЂЩњДпЛЏбѕЛЏЩњГЩ
дйЗЂЩњДпЛЏбѕЛЏЩњГЩ![]() ЃЌОпЬхКЯГЩТЗЯпСїГЬЭМЮЊЃК
ЃЌОпЬхКЯГЩТЗЯпСїГЬЭМЮЊЃК![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаH2SO4КЭHNO3ЕФЛьКЯШмвК20 mLЃЌМгШы0.25 molLЉ1Ba(OH)2ШмвКЪБЃЌЩњГЩГСЕэЕФжЪСПw(g)КЭBa(OH)2ШмвКЕФЬхЛ§V(mL)ЕФЙиЯЕШчЭМЫљЪО(C ЕуЛьКЯвКГЪжаад)ЁЃдђдЛьКЯвКжаH2SO4ЕФЮяжЪЕФСПХЈЖШЮЊ__molЁЄL-1ЃЌHNO3ЕФЮяжЪЕФСПХЈЖШЮЊ__molЁЄL-1ЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЃЌЯТСаЫЕЗЈжае§ШЗЕФЪЧ(ЁЁЁЁ)
A.0.2 molбѕдзгжаКЌ1.6NAИіЕчзг
B.1 mol ТШЛЏУОжаКЌгаРызгЪ§ЮЊNA
C.12.4 gАзСзжаКЌгаСздзгЪ§ЮЊ0.1NA
D.28 gвЛбѕЛЏЬМЦјЬхЫљКЌЕФЕчзгЪ§ЮЊ20NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ20 mL 0.01 mol/L CH3COOHШмвКжаж№ЕЮМгШы0.01 mol/L ЕФNaOHШмвКЃЌШмвКжаЫЎЫљЕчРыГіЕФc(H+)ЫцМгШыNaOHШмвКЕФЬхЛ§БфЛЏЪОвтЭМШчЯТЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
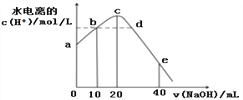
A. ДгaЕНcЃЌЖдДзЫсЕФЕчРыМШгаДйНјзїгУвВгавжжЦзїгУ
B. bЁЂdСНЕуШмвКЕФpHЯрЭЌ
C. eЕуЫљЪОШмвКжаЃЌc(Na+)=2c(CH3COO-)ЃЋ2c(CH3COOH) = 0.01mol/L
D. ДгbЁњdЕФЙ§ГЬжаЃЌМШДцдкpH=7ЕФЕувВДцдкЫЎЕчРыЕФc(H+)=10-7ЕФЕу
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПIЃЎXЪЧвЛжжМЏЯДЕгЁЂЦЏАзЁЂЩБОњгквЛЬхЕФаТаЭЦЏАзМС(гЩЫФжжЖЬжмЦкдЊЫизщГЩЕФДПОЛЮя)ЃЌЮоЖОЮоЮЖЃЌадФмЮТКЭЃЌЧвЖдЛЗОГгбКУЁЃXДгзщГЩаЮЪНЩЯПЩПДГЩЪЧФГжже§бЮMгыЛюадЮяжЪNЕФМгКЯВњЮя(mMЁЄnN ЃЌРрЫЦгкНсОЇЫЎКЯЮяЃЌЯрЖдЗжзгСПВЛГЌЙ§400)ЁЃЯжНЋXАДШчЯТСїГЬЪЕбщЃЌЦјЬхAФмЪЙДјЛ№аЧЕФФОЬѕИДШМЃЌЙЬЬхBШмгкЫЎЫљЕУШмвКЯдМюадЃЌЧвбцЩЋЗДгІГЪЛЦЩЋЁЃ

ЧыЛиД№ЃК
(1) XжаКЌгаЕФЗЧН№ЪєдЊЫиЪЧ________ЃЌаДГіXзЦЩеЕФЛЏбЇЗНГЬЪНЪЧ_________________ЁЃ
(2)ЯђXЕФШмвКжаЭЈШыЩйСПSO2ЃЌЧыаДГіРызгЗНГЬЪН__________________ЁЃ
II ЃЎФГЛЏбЇаЫШЄаЁзщЮЊСЫЬНОПСђЫсЬњШмвКгыЭЗлЗДгІЕФЯоЖШЮЪЬтЃЌЯђвЛЖЈСПЕФСђЫсЬњШмвКжаМгШыЙ§СПЕФЭЗлЃЌГфЗжеёЕДКѓШмвКж№НЅБфРЖЃЌЙ§ТЫЃЌЯђТЫвКжаЕЮМг2ЕЮ0.2mol/L KSCNШмвКЁЃЪЕбщЯжЯѓЮЊЃКШмвКБфЮЊКьЩЋЃЌЕЋеёЕДКѓКьЩЋбИЫйЭЪШЅВЂгаАзЩЋГСЕэЩњГЩЁЃМзЭЌбЇВТЯыГіЯжвьГЃЯжЯѓЪЧгЩгкШмвКжаЕФCu2+ИЩШХСЫFe3+ЕФМьбщЃЌВщдФЯрЙизЪСЯШчЯТЃК
ЂйCuSCNЪЧвЛжжАзЩЋГСЕэЮя
ЂкСђЧш[(SCN)2]ЃКЪЧвЛжжФтТБЫиЃЌаджЪгыТБЫиЕЅжЪЯрЫЦЃЌЦфбѕЛЏадНщгкBr2КЭI2жЎМфЁЃ
(1)ИУаЫШЄаЁзщЫљМЧТМЕФЪЕбщЯжЯѓЫЕУїЭгыЬњРызгЕФЗДгІ__________(ЬюгаЛђУЛга)ЯоЖШЁЃ
(2)ЧыгУРызгЗНГЬЪНЗжБ№НтЪЭЁАШмвКБфЮЊКьЩЋЁБЁЂЁАеёЕДКѓКьЩЋбИЫйЭЪШЅВЂгаАзЩЋГСЕэЩњГЩЁБЯжЯѓЕФдвђЃК___________________________________ЁЂ_________________________________ЁЃ
(3)ЮЊСЫНјвЛВНЬНОПЃЌИУаЁзщЯђЪЂга2mL 0.5mol/L FeSO4КЭ0.2mol/L KSCNЛьКЯШмвКЕФЪдЙмжаЃЌЕЮМг5ЕЮ0.05mol/LСђЫсЭШмвКЃЌгаАзЩЋГСЕэЩњГЩЃЌЧвШмвКБфКьЁЃЧыНтЪЭШмвКБфКьЕФПЩФмдвђ(ПЩвдВЛжЙвЛжж)ЃК
Ђй____________ЃЌЂк___________ЃЌЂл_________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫФжжЖЬжмЦкжїзхдЊЫиWЁЂXЁЂYЁЂZЕФдзгађЪ§вРДЮдіДѓЃЌWЁЂXЕФМђЕЅРызгОпгаЯрЭЌЕчзгВуНсЙЙЃЌXЕФдзгАыОЖЪЧЖЬжмЦкжїзхдЊЫидзгжазюДѓЕФЃЌWгыYЭЌзхЃЌZгыXаЮГЩЕФРызгЛЏКЯЮяЕФЫЎШмвКГЪжаадЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.МђЕЅРызгАыОЖЃК![]()
B.WгыXаЮГЩЕФЛЏКЯЮяШмгкЫЎКѓШмвКГЪМюад
C.ЦјЬЌЧтЛЏЮяЕФШШЮШЖЈадЃК![]()
D.зюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЕФЫсадЃК![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЗДгІA(g)ЃЋB(g) ![]() C(g)ЃЋD(g)ЕФЦНКтГЃЪ§KжЕгыЮТЖШЕФЙиЯЕШчБэЫљЪОЃЌ830 ЁцЪБЃЌЯђвЛИі2 LЕФУмБеШнЦїжаГфШы0.20 mol AКЭ0.20 mol B,10 sЪБДяЦНКтЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
C(g)ЃЋD(g)ЕФЦНКтГЃЪ§KжЕгыЮТЖШЕФЙиЯЕШчБэЫљЪОЃЌ830 ЁцЪБЃЌЯђвЛИі2 LЕФУмБеШнЦїжаГфШы0.20 mol AКЭ0.20 mol B,10 sЪБДяЦНКтЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
ЮТЖШ/Ёц | 700 | 830 | 1200 |
KжЕ | 1.7 | 1.0 | 0.4 |
A. ДяЕНЦНКтКѓЃЌBЕФзЊЛЏТЪЮЊ50%
B. діДѓбЙЧПЃЌе§ЁЂФцЗДгІЫйТЪОљМгПь
C. ИУЗДгІЮЊЮќШШЗДгІЃЌЩ§ИпЮТЖШЃЌЦНКте§ЯђвЦЖЏ
D. ЗДгІГѕЪМжСЦНКтЃЌAЕФЦНОљЗДгІЫйТЪv(A)ЃН0.005 molЁЄLЃ1ЁЄsЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЁзщЭЌбЇРћгУШчЭМЫљЪОзАжУЬНОПЖўбѕЛЏСђЦјЬхЕФаджЪЃЎ
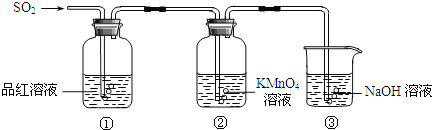
ЧыЛиД№ЃК
ЃЈ1ЃЉЪЕбщЪвгУЭКЭХЈСђЫсЙВШШжЦШЁЖўбѕЛЏСђЃЌЗДгІЕФЛЏбЇЗНГЬЪНЪЧ ЃЎ
ЃЈ2ЃЉЕБЙлВьЕНЂкжаШмвКбеЩЋБфЧГЪБЃЌЂйжаЕФЯжЯѓЪЧ ЃЎ
ЃЈ3ЃЉзАжУЂлЕФзїгУЪЧ ЃЎ
ЃЈ4ЃЉЂйЁЂЂкжаЕФЯжЯѓЫЕУїЖўбѕЛЏСђОпгаЕФаджЪЪЧ ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгаЖЬжмЦкдЊЫиAЁЂBЁЂCЁЂDЁЃAдЊЫиMВуЩЯга2ЖдГЩЖдЕчзгЃЌDгыAдкжмЦкБэжаЭЌвЛжїзхЁЃгЩAЁЂBгыDзщГЩЕФЛЏКЯЮяЕФХЈШмвКЪЧГЃМћЕФИЩдяМСЃЌГЃЮТЯТCЕЅжЪЮЊЫЋдзгЗжзгЃЌЦфЧтЛЏЮяЫЎШмвКГЪМюадЃЌЪЧвЛжжживЊЗЪСЯЁЃ
ЃЈ1ЃЉAЕФдзгзюЭтВуЙВга___жжВЛЭЌдЫЖЏзДЬЌЕФЕчзгЃЌИУдзгЙВга___жжВЛЭЌФмСПЕФЕчзгЃЌФмСПзюИпЕФЕчзгеМга___ИіЙьЕРЃЌЦфЕчзгдЦаЮзДЮЊ____ЁЃ
ЃЈ2ЃЉдЊЫиAЁЂBгыDзщГЩЕФЛЏКЯЮяЕФХЈШмвКЪЧГЃМћИЩдяМСЃЌИУЛЏКЯЮядкЪЕбщЪвжЦБИввЫсввѕЅЪБЫљЦ№ЕФзїгУЃК_____ЁЃ
ЃЈ3ЃЉBгыCдЊЫиаЮГЩДјвЛИіЕЅЮЛе§ЕчКЩЕФРызгЃЌаДГіИУЮЂСЃЕФЕчзгЪН____ЁЃ
ЃЈ4ЃЉдЊЫиAгыдЊЫиDЯрБШЃЌЗЧН№ЪєадНЯЧПЕФЪЧ____(гУдЊЫиЗћКХБэЪО)ЃЌЯТСаБэЪіжаФмБэУїетвЛЪТЪЕЕФЪЧ____ЁЃ
ЂйБШНЯзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЕФЫсад
ЂкБШНЯЖдгІЦјЬЌЧтЛЏЮяЕФЮШЖЈад
ЂлвЛЖЈЬѕМўЯТDФмДгAЕФЧтЛЏЮяЫЎШмвКжажУЛЛГіAЕЅжЪ
ЂмAЕЅжЪЕФШлЗаЕуУїЯдИпгкDЕЅжЪ
ДгдзгНсЙЙЗжЮіAКЭDЗЧН№ЪєЧПШѕЕФдвђ_____ЁЃ
ЃЈ5ЃЉCдзгЕФдзгНсЙЙЪОвтЭМЃК_____ЃЌCЕФЧтЛЏЮяЙЬЬЌЪБЪєгк____ОЇЬхЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com