
【题目】I.X是一种集洗涤、漂白、杀菌于一体的新型漂白剂(由四种短周期元素组成的纯净物),无毒无味,性能温和,且对环境友好。X从组成形式上可看成是某种正盐M与活性物质N的加合产物(mM·nN ,类似于结晶水合物,相对分子量不超过400)。现将X按如下流程实验,气体A能使带火星的木条复燃,固体B溶于水所得溶液显碱性,且焰色反应呈黄色。

请回答:
(1) X中含有的非金属元素是________,写出X灼烧的化学方程式是_________________。
(2)向X的溶液中通入少量SO2,请写出离子方程式__________________。
II .某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(1)该兴趣小组所记录的实验现象说明铜与铁离子的反应__________(填有或没有)限度。
(2)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:___________________________________、_________________________________。
(3)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):
①____________,②___________,③_________
【答案】C、H、O 2[2Na2CO3·3H2O2] ![]() 4Na2CO3+6H2O+3O2↑ 2CO
4Na2CO3+6H2O+3O2↑ 2CO![]() + H2O2+ SO2= SO
+ H2O2+ SO2= SO![]() + 2HCO
+ 2HCO![]() 有 Fe3++ 3SCN-= Fe(SCN)3 4Fe(SCN)3 + 6Cu2+= 4Fe3++ 6CuSCN↓ + 3(SCN)2 Cu2+可以将Fe2+氧化成Fe3+,Fe3+遇SCN-变红 Cu2+氧化SCN-为(SCN)2,(SCN)2可氧化Fe2+氧化成Fe3+,Fe3+遇SCN-变红 ——
有 Fe3++ 3SCN-= Fe(SCN)3 4Fe(SCN)3 + 6Cu2+= 4Fe3++ 6CuSCN↓ + 3(SCN)2 Cu2+可以将Fe2+氧化成Fe3+,Fe3+遇SCN-变红 Cu2+氧化SCN-为(SCN)2,(SCN)2可氧化Fe2+氧化成Fe3+,Fe3+遇SCN-变红 ——
【解析】
I.干燥管增重1.08g,说明X中含有H元素,生成的水蒸气的物质的量为![]() =0.06mol;固体B溶于水所得溶液显碱性,且焰色反应呈黄色,说明X中含有钠元素;固体B溶解后滴加氯化钙溶液,生成白色沉淀,X是由四种短周期元素组成的纯净物,无毒无味,性能温和,且对环境友好,则该白色沉淀为碳酸钙,说明X中含有C元素,B为Na2CO3;碳酸钙的质量为4.00g,物质的量为
=0.06mol;固体B溶于水所得溶液显碱性,且焰色反应呈黄色,说明X中含有钠元素;固体B溶解后滴加氯化钙溶液,生成白色沉淀,X是由四种短周期元素组成的纯净物,无毒无味,性能温和,且对环境友好,则该白色沉淀为碳酸钙,说明X中含有C元素,B为Na2CO3;碳酸钙的质量为4.00g,物质的量为![]() =0.04mol;则6.28g X中含有0.12molH、0.08molNa、0.04molC;根据质量的关系分析判断是否含有O元素,结合X是某种正盐M与活性物质N的加合产物,且相对分子量不超过400,分析判断X的化学式;
=0.04mol;则6.28g X中含有0.12molH、0.08molNa、0.04molC;根据质量的关系分析判断是否含有O元素,结合X是某种正盐M与活性物质N的加合产物,且相对分子量不超过400,分析判断X的化学式;
II .向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,说明铁离子被还原生成亚铁离子,铜被氧化得到铜离子,发生反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+;过滤,向滤液中滴加2滴0.2mol/L KSCN溶液,溶液变为红色,说明溶液中含有Fe3+,振荡后红色迅速褪去并有白色沉淀生成,是因为生成了CuSCN白色沉淀,据此分析解答。
I.根据上述分析,6.28g X中含有0.12molH、0.08molNa、0.04molC;0.12molH、0.08molNa、0.04molC的质量之和为0.12mol×1g/mol+0.08mol×23g/mol+0.04mol×12g/mol=2.44g<6.28g,说明X中含有O元素,且质量=6.28g-2.44g=3.84g,物质的量为![]() =0.24mol,X中N(Na)∶N(C)∶N(H)∶N(O)= 0.08mol∶0.04mol∶0.12mol∶0.24mol= 2∶1∶3∶6,X从组成形式上可看成是某种正盐M与活性物质N的加合产物,气体A能使带火星的木条复燃,气体A为氧气且其物质的量为0.03mol,则M为Na2CO3,N为H2O2,6.28gX中含有0.04mol Na2CO3,0.06mol H2O2,相对分子量不超过400,则X的化学式为2Na2CO3·3H2O2。
=0.24mol,X中N(Na)∶N(C)∶N(H)∶N(O)= 0.08mol∶0.04mol∶0.12mol∶0.24mol= 2∶1∶3∶6,X从组成形式上可看成是某种正盐M与活性物质N的加合产物,气体A能使带火星的木条复燃,气体A为氧气且其物质的量为0.03mol,则M为Na2CO3,N为H2O2,6.28gX中含有0.04mol Na2CO3,0.06mol H2O2,相对分子量不超过400,则X的化学式为2Na2CO3·3H2O2。
(1) X中含有的非金属元素是C、H、O,X灼烧生成碳酸钠,水和氧气,反应的化学方程式为2[2Na2CO3·3H2O2] ![]() 4Na2CO3+6H2O+3O2↑,故答案为:C、H、O;2[2Na2CO3·3H2O2]
4Na2CO3+6H2O+3O2↑,故答案为:C、H、O;2[2Na2CO3·3H2O2] ![]() 4Na2CO3+6H2O+3O2↑;
4Na2CO3+6H2O+3O2↑;
(2)过氧化氢具有氧化性,能够氧化二氧化硫,向X的溶液中通入少量![]() + H2O2+ SO2= SO
+ H2O2+ SO2= SO![]() + 2HCO
+ 2HCO![]() ,故答案为:2CO
,故答案为:2CO![]() + H2O2+ SO2= SO
+ H2O2+ SO2= SO![]() + 2HCO
+ 2HCO![]() ;
;
II .(1)根据上述分析,一定量的硫酸铁溶液中加入过量的铜粉,反应后的溶液中还含有Fe3+,说明铜与铁离子的反应有限度,故答案为:有;
(2)向滤液中滴加2滴0.2mol/L KSCN溶液,溶液变为红色,说明溶液中含有Fe3+,反应的离子方程式为Fe3++ 3SCN-= Fe(SCN)3;振荡后红色迅速褪去并有白色沉淀生成,是因为生成了CuSCN白色沉淀,硫氰[(SCN)2]的性质与卤素单质相似,其氧化性介于Br2和I2之间,说明Fe3+不能与(SCN)2发生氧化还原反应,反应的离子方程式为4Fe(SCN)3 + 6Cu2+= 4Fe3++ 6CuSCN↓ + 3(SCN)2,故答案为:Fe3++ 3SCN-= Fe(SCN)3;4Fe(SCN)3 + 6Cu2+= 4Fe3++ 6CuSCN↓ + 3(SCN)2;
(3)向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。白色沉淀为CuSCN;溶液变红是因为溶液中存在了Fe3+,Fe3+遇SCN-变红,出现Fe3+可能是Cu2+将Fe2+氧化成Fe3+,也可能是硫氰[(SCN)2]将亚铁离子氧化生成铁离子等,故答案为:Cu2+可以将Fe2+氧化成Fe3+,Fe3+遇SCN-变红;Cu2+氧化SCN-为(SCN)2,(SCN)2可氧化Fe2+氧化成Fe3+,Fe3+遇SCN-变红。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL 0.40mol/L H2O2 溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:υ(H2O2)=3.3×10-2mol/(L·min)
B.6~10min的平均反应速率:υ(H2O2)<3.3×10-2mol/(L·min)
C.反应到6min时,c(H2O2)=0.30mol/L
D.反应到6min时,H2O2 分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验需要450mL0.10mol·L-1Na2CO3溶液,某同学选用Na2CO3·10H2O 晶体进行配制,简要回答下列问题:
(1)该实验应选择____mL容量瓶。
(2)需称取Na2CO3·10H2O的质量为_____g。
(3)该实验的正确操作顺序是_____(填字母代号)。
A.用托盘天平称取Na2CO3·10H2O晶体
B.上下颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器并将洗涤液转移进容量瓶
E.将所称取的晶体溶于蒸馏水并冷却至室温
F.将溶液转入容量瓶
(4)下列操作对溶液浓度有何影响(填“偏高”、“偏低”或“无影响”)。
①若容量瓶中有检漏时残留的少量蒸馏水,会使所配溶液浓度_____;
②配制过程中未洗涤烧杯和玻璃棒,会使浓度_____;
③NaOH溶解后未经冷却立即注入容量瓶至刻度线,会使浓度____;
④定容时必须使凹液面最低处与刻度线相切,若仰视会使所配溶液浓度_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )
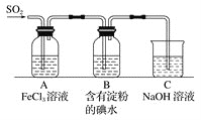
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
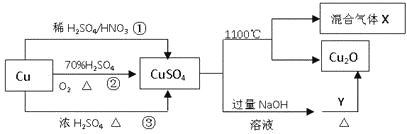
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol
D.Y可以是甲酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列小题。
(1)某有机物X含有C、H元素,可能含有O元素。取0.46g X在氧气中完全燃烧,将燃烧后的产物依次通过浓硫酸和碱石灰,测得浓硫酸增重0.54g,碱石灰增重0.88g。由实验分析计算可得X的____(填“实验式”、“分子式”或“结构简式”)为____。
(2)有机物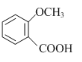 含有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:____。①能发生银镜反应;②与FeCl3发生显色反应;③苯环上的一元取代物只有1种
含有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:____。①能发生银镜反应;②与FeCl3发生显色反应;③苯环上的一元取代物只有1种
(3)化合物D是合成神经保护剂依那朵林的中间体,合成路线如下:
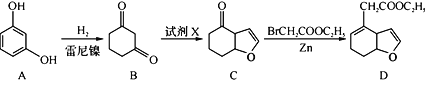
请写出以![]() 和BrCH2COOC2H5为原料制备
和BrCH2COOC2H5为原料制备![]() 的合成路线流程图(无机试剂任用。合成示例例见本题题干)____。
的合成路线流程图(无机试剂任用。合成示例例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 氧化钠可用作潜艇供氧剂
B. 单晶硅用于制备光导纤维
C. 食盐可通过侯氏制碱法制备纯碱
D. 氯化亚铁用于蚀刻工业铜电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)═2NO(g)+O2(g)在体积不变的密闭容器中反应,现有以下几种说法:
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
其中表示反应达到平衡状态的是
A. ①③⑤ B. ②④⑥ C. ②③④⑥ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.46gNO2和N2O4混合气体中所含的原子总数为3NA
B.反应4FeS2+11O2![]() 2Fe2O3+8SO2每生成2molFe2O3转移电子总数为44NA
2Fe2O3+8SO2每生成2molFe2O3转移电子总数为44NA
C.22.4L的N2和O2所含的分子总数为NA,该混合气体所处的状况为标准状况
D.含1molFeCl3的饱和溶液滴加到沸水中,所得氢氧化铁胶体分散质的粒子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com