
【题目】在一定温度下,10mL 0.40mol/L H2O2 溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:υ(H2O2)=3.3×10-2mol/(L·min)
B.6~10min的平均反应速率:υ(H2O2)<3.3×10-2mol/(L·min)
C.反应到6min时,c(H2O2)=0.30mol/L
D.反应到6min时,H2O2 分解了50%
【答案】C
【解析】
A.6分钟时氧气的物质的量为![]() ,所以反应消耗的过氧化氢的物质的量为0.002mol,用过氢氧化氢表示反应速率为
,所以反应消耗的过氧化氢的物质的量为0.002mol,用过氢氧化氢表示反应速率为![]() mol/(L·min)=3.3×10-2mol/(L·min),故正确;
mol/(L·min)=3.3×10-2mol/(L·min),故正确;
B. 6~10min 氧气的生成量为29.9mL-22.4mL=7.5mL,过氧化氢的消耗量为![]() mol,用过氢氧化氢表示反应速率为
mol,用过氢氧化氢表示反应速率为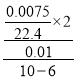 mol/(L·min)<3.3×10-2mol/(L·min),故正确;
mol/(L·min)<3.3×10-2mol/(L·min),故正确;
C. 6分钟时,反应消耗的过氧化氢的物质的量为0.002mol,剩余过氧化氢的物质的量为0.01L×0.40mol/L-0.002mol=0.002mol,浓度为![]() mol/L=0.20 mol/L ,故错误;
mol/L=0.20 mol/L ,故错误;
D.到6分钟时反应消耗的过氧化氢的物质的量为0.002mol,分解率为![]() ×100%=50%,故正确。
×100%=50%,故正确。
故选C。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确旳是 ( )
A.碳酸氢铵和足量旳氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O
B.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+
C.用稀硝酸浸泡做过银镜反应旳试管:Ag+2H++NO3-=Ag++NO2↑+H2O
D.偏铝酸钠溶液中通入过量旳二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为CuFeS2。试回答下列问题:
(1)基态Cu原子的核外电子排布式为________;Cu、Zn的第二电离能大小I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(2)SO2分子中分子空间构型为________;与SO2互为等电子体的阴离子有________(写一种)。
(3)[Cr(H2O)4Br2]Br·2H2O中心离子配位数为_______
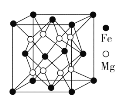
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。晶胞距离Mg原子最近Mg数目为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环扁桃酯具有松弛血管平滑肌,扩张血管的功能,其一种同系物(X)可以发生如下转化,下列说法中错误的是( )
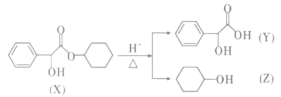
A.X的分子式为C14H18O3
B.Y可以发生氧化反应、还原反应、酯化反应、缩聚反应
C.Y中最多可以有15个原子共平面
D.Z的同分异构体含有醛基(一CHO)有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)![]() 2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______.
A.消耗1molN2同时生成1molO2![]() 混合气体密度不变
混合气体密度不变
C.混合气体平均相对分子质量不变D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态![]() 与原平衡状态相比,此时平衡混合气中NO的体积分数______
与原平衡状态相比,此时平衡混合气中NO的体积分数______![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]()
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量相等的CO和CO2中,同温同压下所占的体积比为____,原子个数之比为____。
(2)1.8g水与____mol硫酸所含的分子数相等,它们所含氧原子数之比是____,其中氢原子数之比是_____。
(3)3.2g某气体中含有的分子数约为3.01×1022,此气体的摩尔质量为_____。
(4)可用于分离或提纯物质的方法有:
A.过滤B.萃取C.渗析D.蒸馏E.灼热氧化F.分液。如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
①除去淀粉溶液中的少量碘化钠____;
②提取溴水中的溴单质_____;
③除去CuO中的Cu_____;
④除去水中的Na+、SO42-、Cl-等杂质_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.X是一种集洗涤、漂白、杀菌于一体的新型漂白剂(由四种短周期元素组成的纯净物),无毒无味,性能温和,且对环境友好。X从组成形式上可看成是某种正盐M与活性物质N的加合产物(mM·nN ,类似于结晶水合物,相对分子量不超过400)。现将X按如下流程实验,气体A能使带火星的木条复燃,固体B溶于水所得溶液显碱性,且焰色反应呈黄色。

请回答:
(1) X中含有的非金属元素是________,写出X灼烧的化学方程式是_________________。
(2)向X的溶液中通入少量SO2,请写出离子方程式__________________。
II .某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(1)该兴趣小组所记录的实验现象说明铜与铁离子的反应__________(填有或没有)限度。
(2)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:___________________________________、_________________________________。
(3)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):
①____________,②___________,③_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com