
����Ŀ������β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£�
N2(g)+O2(g)![]() 2NO(g)����H>0����֪�÷�Ӧ��240����ƽ�ⳣ��K=64��10-4����ش�
2NO(g)����H>0����֪�÷�Ӧ��240����ƽ�ⳣ��K=64��10-4����ش�
(1)ij�¶��£���2L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol����N2�ķ�Ӧ����Ϊ______��
(2)�ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־______��
A.����1molN2ͬʱ����1molO2![]() ��������ܶȲ���
��������ܶȲ���
C.�������ƽ����Է�����������D.2v��(N2)=v��(NO)
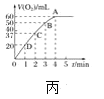
(3)��N2��O2�Ļ�����������º����ܱ������У���ͼ�仯������ȷ����______(����ĸ���)��

(4)����º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬![]() ��ԭƽ��״̬��ȣ���ʱƽ��������NO���������______
��ԭƽ��״̬��ȣ���ʱƽ��������NO���������______![]() ���������������С������������
���������������������������![]()
(5)���¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1mol/L��4.0��10-2mol/L��3.0��10-3mol/L����ʱ��Ӧ______(�������ڻ�ѧƽ��״̬������������Ӧ����������������淴Ӧ���������)��������______��
���𰸡�0.05mol/(L��min) AD AC ���� ������Ӧ������� ��ΪŨ����Qc<K
��������
(1)�ȸ������ʶ���ʽ����v(O2)��Ȼ����ݲ�ͬ���ʱ�ʾ�����ʱȵ��ڻ�ѧ�������ıȼ���v(N2)��
(2)���淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ�������(ͬ������)�����淴Ӧ����֮�ȵ���ϵ��֮��(��ͬ����)��ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯���ɴ�������һЩ���������䣬�Դ˷�����
(3)�����¶ȶԻ�ѧ��Ӧ���ʺͻ�ѧƽ���ƶ���Ӱ�����AC��
���ݴ������Լӿ췴Ӧ���ʣ�������ʹ��ѧƽ���ƶ�����B��
(4)���ݻ�ѧ����ʽ���ص���ѹǿ��ƽ���Ӱ�������
(5)����ijʱ���������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ������¶��µ�ƽ�ⳣ����Ƚϣ��ɵó����ۡ�
(1)5�����ڣ���n(O2)=1mol-0.5mol=0.5mol����v(O2)=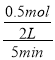 =0.05 mol/(L��min)�����ݷ�Ӧ����ʽN2(g)+O2(g)
=0.05 mol/(L��min)�����ݷ�Ӧ����ʽN2(g)+O2(g)![]() 2NO(g)��֪v(N2)=v(O2)=
2NO(g)��֪v(N2)=v(O2)=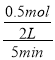 =0.05 mol/(L��min)��
=0.05 mol/(L��min)��
(2)A.����1molN2��Ч������1mol O2��ͬʱ����1mol O2��˵�����淴Ӧ�������(ͬ������)����Ӧ�ﵽƽ�⣬A�������⣻
B.�����������������䣬������������䣬���۷�Ӧ�Ƿ�ƽ�⣬��������ܶ�һֱ���䣬B���������⣻
C.�����������������䣬�ܵ����ʵ���Ҳ���䣬���۷�Ӧ�Ƿ�ƽ�⣬�������ƽ����Է�������ʼ�ղ��䣬���ܾݴ��жϷ�Ӧ�Ƿ���ƽ��״̬��C���������⣻
D. 2v��(N2)=v��(NO)= v��(NO)��˵�����淴Ӧ�������(ͬ������)��˵����Ӧ�ﵽƽ��״̬��D�������⣻
�ʺ���ѡ����AD����
(3)�÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶�ƽ��������Ӧ���У���ѧƽ�ⳣ������A��ȷ��
B.������������Լӿ컯ѧ��Ӧ���ʣ����Ի�ѧƽ���ƶ���Ӱ�죬���ƽ�ⲻ�����ƶ������ʵ�ƽ�⺬�����䣬B����
C.�����¶ȣ���ѧ��Ӧ�������ﵽƽ������Ҫ��ʱ�����̣��ȴﵽƽ�⣬���ڸ÷�Ӧ������Ӧ�����ȷ�Ӧ�������¶ȣ���ѧƽ��������Ӧ�����ƶ���ʹN2��ת��������C��ȷ��
�ʺ���ѡ����AC��
(4)�÷�Ӧ�У�����Ļ�ѧ������֮��ǰ����ȣ�ѹǿ��ƽ���ƶ�û��Ӱ�죬ֻҪ������ͬ�¶��£���ƽ��״̬��ͬ����ԭƽ��״̬��ȣ���ʱƽ��������NO������������䣻
(5)���¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1mol/L��4.0��10-2mol/L��3.0��10-3mol/L�����ʱ���������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵΪQc=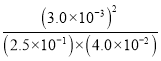 =9.0��10-4<K��˵����Ӧδ�ﵽƽ�⣬��ӦӦ������Ӧ������С�
=9.0��10-4<K��˵����Ӧδ�ﵽƽ�⣬��ӦӦ������Ӧ������С�


 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2���ȶ����ֽ⣬Fe3����Cu2���ȶ���ֽ�������ã�Ϊ�Ƚ�Fe3����Cu2����H2O2�ֽ�Ĵ�Ч����ij��ѧ�о�С��ͬѧ�ֱ��������ͼ�ס�������ʵ��װ�á�
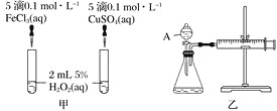
��1��������ͼ��װ�ã���ͨ���۲�__________���Ӷ����ԱȽϵó����ۡ�
��2����ͬѧ�����FeCl3��ΪFe2(SO4)3��Ϊ�������������� ________��д��H2O2�ڶ������̴������·�����Ӧ�Ļ�ѧ����ʽ��___________��
��3����������ʵ��ɽ��ж���������ͼ��������A������Ϊ________��ʵ��ʱ��������40mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�ʵ���л���Ҫ������������________��
��4����0.1molMnO2��ĩ����50 mL H2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ����ʾ�����ͷ�Ӧ���ʱ仯��ԭ��________��H2O2��ʼ���ʵ���Ũ��Ϊ_______(������λС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ҫ�Ե⻯����ʽ���ڡ���һ��ѧ����С���ú���Ϊԭ����ȡ�����ⵥ�ʣ����ǽ��������ճɻң���ˮ����һ��ʱ�䣨�⻯�����ܽ���ˮ�У����õ�����������Һ��Ȼ������ʵ��������ȡ���ʵ⣺����֪��2I-+Cl2=2Cl-+I2��
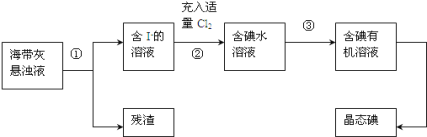
(1)ָ����ȡ��Ĺ������йص�ʵ��������ƣ���______���� _____��
(2)���̢��г�������Cl2��Ŀ����(�÷���ʽ����)_________________������Һ�е�I-ת����I2��
(3)�����������õ��л��Լ�������______________(ֻ��һ��)��
(4)�������̢ۿ��Էֽ�Ϊ���¼�����
A.��ʢ����Һ�ķ�Һ©����������̨����Ȧ�У�
B.��50mL��ˮ��15mL�л��ܼ������Һ©���У����Ǻò�������
C.�����Һ©���������ϿڵIJ������Ƿ�©Һ��
D.��ת©������������ʱ�����������������رջ������ѷ�Һ©��������
E.�������������ձ�������Һ��
F.�ӷ�Һ©���Ͽڵ����ϲ�Һ�壻
G.��©���ϿڵIJ�������ʹ���ϵİ�����©���Ͽڵ�С����
H.���á��ֲ㡣
���̢���ȷ���������˳���ǣ���������ĸ��_______��________��________��A��H��________��E��F��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ɳ�����չ������أ������й�˵�����������ȷ���ǣ� ��
��Ϊ��ǿ����Һ����Ч�ɷ�NaClO�����������������ԵμӼ���Ũ����
���¹ڲ������Բ��ø��»�ƾ���ɱ���������õ��ǵ����ʵı���
�۳����Ļ�ѧ�������Ӽ������ۼ������
��ʯ�͵����������������仯����ú�ĸ����ǻ�ѧ�仯
�ݹ������׳�ˮ����
�ޱ��ڹ�ҵ�ϣ��ȿ�����úΪԭ���Ʊ���Ҳ������ʯ��Ϊԭ���Ʊ�
A.�٢ڢ�B.�٢ۢ�C.�ۢݢ�D.�٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������4����Һ�ֱ�������ͼ��װ���У�����������ͬʱ��������������(����)
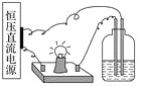
A. 100 mL 1 mol��L��1������
B. 100 mL 2 mol��L��1��������Һ
C. 100 mL 1 mol��L��1���Ȼ�����Һ
D. 30 mL 1 mol��L��1���Ȼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10mL 0.40mol/L H2O2 ��Һ�������ֽ⡣��ͬʱ�̲������O2�����(������Ϊ��״��)���±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ����(��Һ����仯���Բ���)
A.0~6min��ƽ����Ӧ���ʣ���(H2O2)=3.3��10-2mol/(L��min)
B.6~10min��ƽ����Ӧ���ʣ���(H2O2)��3.3��10-2mol/(L��min)
C.��Ӧ��6minʱ��c(H2O2)=0.30mol/L
D.��Ӧ��6minʱ��H2O2 �ֽ���50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20mL0.1mol/L��NaHCO3��Һ�еμ�0.1mol/L��ˮ(��֪������H2CO3Ka1=4.2��10-7��Ka2=5.6x10-11)��NH3H2O(Kb=1.78��10-5)������˵��������ǣ� ��
A.0.1mol/L��NaHCO3��Һ�У�c(OH-)+c(CO![]() )=c(H2CO3)+c(H+)
)=c(H2CO3)+c(H+)
B.���۵μӶ��ٰ�ˮ����Һ��һ�����㣺c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)=c(Na+)
)+c(H2CO3)=c(Na+)
C.������10mL��ˮʱ��������Ӧ�����ӷ���ʽΪ��HCO![]() +NH3��H2O=CO
+NH3��H2O=CO![]() +NH
+NH![]() +H2O���÷�Ӧ��ƽ�ⳣ��ԼΪ0.1
+H2O���÷�Ӧ��ƽ�ⳣ��ԼΪ0.1
D.������20mL NH3��H2Oʱ��c(Na+)=c(NH![]() )+c(NH3��H2O)=0.1mol/L
)+c(NH3��H2O)=0.1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������IJ�ҩ�����Ŀɰ�������Ҫ�м��塣�������������������㾫��ʳƷ���ϵ���Ҫԭ�ϡ�����ũ�����Ϻй���֬�Ⱦ�ϸ������Ʒ��������Ҳ���Ź㷺��Ӧ�á�ʵ���Һϳ������ķ�Ӧԭ������

�������ʵ�����������±���ʾ��
���� | ��Է������� | �۵�/�� | �е�/�� | ��Ҫ���� |
����ȩ | 106.0 | -26 | 179 | ��ƷΪ��ɫҺ�壬����ˮ�������м����ױ��������� |
������ | 102.0 | -73.1 | 138.6 | ��ɫ��Һ�壻���ݼ�����ζ��������Ϊ���ᶾ������ˮǿ��ˮ���������ᣬ������������ |
����� | 148.0 | 133 | 300 | ��ɫ������ɫ��ĩ���й�Ƥ���� |
ʯ�� | / | 50-70 | 300-550 | ��Ҫ��������ɣ������ȶ� |
ʵ�鲽�����£�
����1��������ˮ����ء�14.5mL������(����)��5.0mL����ȩ(�ܶ�Ϊ1.06g/cm3)���μ���150ml������ƿ��ҡ�ȣ�������ӣ���û���װ�ã��ô��������蹦�ܵĵ�¯(ͼA)�������кּ��Ȼ���1Сʱ��
����2��ȡ��������ƿ����ȴ��100�����º�����������̼������Һ����pH8-9��
����3����ͼB���Ӻ�ˮ��������װ�ã�����װ����ȥ��������ˮ��������ֱ����������͵Σ�
����4����������ƿ�еIJ���Һ��ȴ��������̿����У�____����Һ�б߽���ߵμ�Ũ������pH=3����������������
����5����ѹ���ˣ�ϴ�ӣ���ɣ����������۵㡣
�ش��������⣺
(1)����1�У����þƾ��Ƽ��ȣ����ܴ��ڵİ�ȫ������__��
(2)����2�У��ӱ���̼������Һ��Ŀ����___���ɹ۲쵽������������__��
(3)����3�У�ˮ���������Ŀ���dz�ȥ__��(����������)
(4)����4�У�ȱʧ�IJ���������__��
(5)����5�У��������õ��IJ�Ʒ����Ϊ4.800g����ʵ��IJ���Ϊ__%(����4λ��Ч����)��

(6)�л����й̶����۵㣬��˲�����Ʒ���۵���Գ����ж����õIJ�Ʒ�Dz���Ԥ�ڲ�����Ʒ�۵��װ����ͼC��ʾ������Ʒװ��һ�˷�ڵ�ëϸ�������У����¶ȼư���һ�𣬲���b�ιܣ�ͼD���У��û����������b�ι��Ҳ࣬�۲�ëϸ������Ʒ��״̬�Լ���Ӧ�¶ȼƵ�ʾ�������ɲ����Ʒ���۳̣��տ�ʼ����Һ����ǡ����ȫ�ۻ����¶ȷ�Χ�����ⶨ�����У��¶ȼƵ�ˮ����Ӧλ��__������m������n������p������b�ι�����װ����ԡҺ��ѡ��__������Ӧ��ĸ��ţ���
A.����ˮ B.Ũ���� C.ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��һ����Ҫ�Ļ���ԭ�ϣ����й��Ʊ�;����������ͼ��ʾ������˵������ȷ����
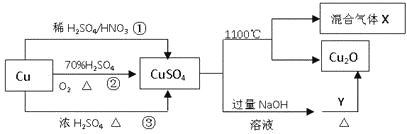
A.;�������û�����H2SO4��HNO3���ʵ���֮�����Ϊ3:2
B.�����;���١��ۣ�;���ڸ��õ���������ɫ��ѧ˼��
C.1molCuSO4��1100�����û������X��O2����Ϊ0.75mol
D.Y�����Ǽ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com