
【题目】肉桂酸是生产冠心病药物“心可安”的重要中间体。其酯类衍生物是配制香精和食品香料的重要原料。它在农用塑料和感光树脂等精细化工产品的生产中也有着广泛的应用。实验室合成肉桂酸的反应原理如下

部分物质的相关性质如下表所示:
名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 主要性质 |
苯甲醛 | 106.0 | -26 | 179 | 纯品为无色液体,微溶于水;空气中加热易被缓慢氧化 |
乙酸酐 | 102.0 | -73.1 | 138.6 | 无色透明液体;有剌激性气味;其蒸气为催泪毒气,遇水强烈水解生成乙酸,产生大量酸雾 |
肉桂酸 | 148.0 | 133 | 300 | 白色至淡黄色粉末;微有桂皮香气 |
石蜡 | / | 50-70 | 300-550 | 主要由烷烃组成,性质稳定 |
实验步骤如下:
步骤1:适量无水醋酸钾、14.5mL乙酸酐(过量)和5.0mL苯甲醛(密度为1.06g/cm3)依次加入150ml三颈烧瓶中摇匀,放入磁子,搭好回流装置,用带磁力搅拌功能的电炉(图A)加热至微沸后保持加热回流1小时;
步骤2:取下三口烧瓶,冷却至100度以下后,加入少量饱和碳酸钠溶液调节pH8-9;
步骤3:如图B连接好水蒸气蒸馏装置(加热装置略去),进行水蒸气蒸馏,直至馏出物无油滴;
步骤4:将三口烧瓶中的残余液冷却后加入活性炭,煮沸,____往滤液中边搅拌边滴加浓盐酸至pH=3,大量固体析出;
步骤5:减压过滤,洗涤,烘干,称量,测熔点。
回答下列问题:
(1)步骤1中,若用酒精灯加热,可能存在的安全隐患是__。
(2)步骤2中,加饱和碳酸钠溶液的目的是___,可观察到的明显现象是__。
(3)步骤3中,水蒸气蒸馏的目的是除去__。(填物质名称)
(4)步骤4中,缺失的操作名称是__。
(5)步骤5中,若称量得到的产品质量为4.800g,则本实验的产率为__%(保留4位有效数字)。

(6)有机都有固定的熔点,因此测量产品的熔点可以初步判定所得的产品是不是预期产物。测产品熔点的装置如图C所示:将产品装入一端封口的毛细玻璃管中,与温度计绑在一起,插入b形管(图D)中,用火焰持续加热b形管右侧,观察毛细管中样品的状态以及相应温度计的示数,即可测得样品的熔程(刚开始出现液滴至恰好完全熔化的温度范围)。测定过程中,温度计的水银球应位于__(填“m”、“n”或“p”),b形管中所装的热浴液可选用__(填相应字母编号)。
A.蒸馏水 B.浓硫酸 C.石蜡
【答案】可能引燃有机物发生火灾 将肉桂酸转化为肉桂酸的钠盐,减少蒸馏时的挥发损失 产生大量气泡和酸雾 苯甲醛 趁热过滤 64.86 n BC
【解析】
(1)步骤1中,三颈烧瓶中盛有乙酸酐(过量)和苯甲醛,属于易燃有机物,若用酒精灯加热,可能存在的安全隐患是引燃有机物发生火灾;
(2)步骤1发生反应![]() 得到肉桂酸和乙酸,还有过量的乙酸酐,步骤3将进行蒸馏,肉桂酸有挥发性,需进行保护,故步骤2中,加饱和碳酸钠溶液的目的是将肉桂酸转化为肉桂酸的钠盐,减少蒸馏时的挥发损失,加入的饱和碳酸钠溶液,根据表格信息可知乙酸酐遇水强烈水解生成乙酸,产生大量酸雾,乙酸与碳酸钠反应产生大量气泡,现象为产生大量气泡和酸雾;
得到肉桂酸和乙酸,还有过量的乙酸酐,步骤3将进行蒸馏,肉桂酸有挥发性,需进行保护,故步骤2中,加饱和碳酸钠溶液的目的是将肉桂酸转化为肉桂酸的钠盐,减少蒸馏时的挥发损失,加入的饱和碳酸钠溶液,根据表格信息可知乙酸酐遇水强烈水解生成乙酸,产生大量酸雾,乙酸与碳酸钠反应产生大量气泡,现象为产生大量气泡和酸雾;
(3)步骤3中,进行水蒸气蒸馏,直至馏出物无油滴,说明目的是为了除去油状物质,符合题意的只有苯甲醛;
(4)步骤4中,缺失的操作名称是趁热过滤,若冷却则肉桂酸钠会结晶被过滤,造成目标产物损失,影响产率计算;
(5)步骤5中,通过苯甲醛的量按方程进行计算,肉桂酸的理论质量为5.0×1.06×148/106g=7.4g,产率=4.800g/7.4g×100%≈64.86%;
(6)温度计插入b形管的深度以水银球恰好在b形管的两侧管中部,故在n位置,肉桂酸熔点为133℃,高于100℃低于140℃,故可选热浴液为浓硫酸和石蜡,答案选BC。


科目:高中化学 来源: 题型:
【题目】下列关于物质的用途及反应方程式的叙述不正确的是( )
A.印刷电路板时用FeCl3作为腐蚀液:2Fe3+ + Cu == 2Fe2+ + Cu2+
B.用HF雕刻玻璃:SiO2 + 4HF == SiF4↑ + 2H2O
C.高炉炼铁的主要原理:CO + FeO == Fe + CO2
D.小苏打做发酵粉:2NaHCO3 == Na2CO3 + H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)![]() 2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______.
A.消耗1molN2同时生成1molO2![]() 混合气体密度不变
混合气体密度不变
C.混合气体平均相对分子质量不变D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态![]() 与原平衡状态相比,此时平衡混合气中NO的体积分数______
与原平衡状态相比,此时平衡混合气中NO的体积分数______![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]()
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼制石油能得到许多有机化合物,相关物质的转化关系如下图所示,其中A的产量是衡量一个国家石油化工发展水平的重要标志,标况下,B气体的密度为0.71gL-1,C是一种红色固体单质,D是一种混合气体。

请回答:
(1)A的结构简式为______,A与溴的四氯化碳溶液的反应类型为______。
(2)B与CuO反应的化学方程式______。
(3)下列说法不正确是______。
A.A中所有原子共平面
B.A与溴的四氯化碳溶液反应现象,和A与溴水反应的现象完全相同
C.等物质的量A与B混合物在足量氧气中完全燃烧,生成水的物质的量相等
D.B是引起温室效应的气体之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量相等的CO和CO2中,同温同压下所占的体积比为____,原子个数之比为____。
(2)1.8g水与____mol硫酸所含的分子数相等,它们所含氧原子数之比是____,其中氢原子数之比是_____。
(3)3.2g某气体中含有的分子数约为3.01×1022,此气体的摩尔质量为_____。
(4)可用于分离或提纯物质的方法有:
A.过滤B.萃取C.渗析D.蒸馏E.灼热氧化F.分液。如欲分离或提纯下列各组混合物,请选择上述方法中最合适者,并将相应字母填入题后空格内:
①除去淀粉溶液中的少量碘化钠____;
②提取溴水中的溴单质_____;
③除去CuO中的Cu_____;
④除去水中的Na+、SO42-、Cl-等杂质_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.水杨酸和阿司匹林互为同系物
B.H2 和 D2 互为同素异形体
C.甲苯分子中所有碳原子均共平面
D.分子式为 C3H6BrCl 和C3H6Br2的有机物的同分异构体个数相同(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中放出的热量为______kJ。
(2)肼(N2H4)-空气燃料电池(产物为N2和H2O)是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_______,负极的电极反应式:_______。
(3)如图是一个电解过程示意图。
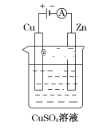
①锌片上发生的电极反应式是:____________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气______L.(假设空气中氧气体积分数为20%;Cu相对原子质量:64)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
A. AB. BC. C...D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com