
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:![]()
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:![]()
D.最高价氧化物的水化物的酸性:![]()
【答案】B
【解析】
四种短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na;由原子序数可知,Y、Z处于第三周期,而Z与X(钠)形成的离子化合物的水溶液呈中性,则Z为Cl;W、X的简单离子具有相同电子层结构,且W与Y同族,W在第二周期且是非金属元素,W可能是N或O,则对应的Y为P或S。
由上述分析可知,W为N或O,X为Na,Y为P或S,Z为Cl,
A. X与W的离子电子层结构相同,简单离子半径:![]() ,故A错误;
,故A错误;
B. W与X形成的化合物Na3N、Na2O、Na2O2溶于水后溶液呈碱性,故B正确;
C. W与Y同族,气态氢化物的热稳定性:![]() ,故C错误;
,故C错误;
D.Y、Z处于第三周期, 最高价氧化物的水化物的酸性取决于非金属性,故:![]() ,故D错误;
,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M均为短周期元素且原子序数依次增大,W和X同族。Y原子最外层电子数是W与X原子最外层电子数之和的3倍,是Z原子最外层电子数的2倍,M的最高正价与最低负价代数和为6。下列说法正确的是
A.离子半径:W-<X+
B.化合物XZW4的结构如图所示,且有还原性

C.工业上可以用电解Z、M的熔融态化合物制备Z单质
D.W与Y形成的化合物均不能使品红溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.金属和一定量的任意酸反应,只要放出2 g氢气,则转移的电子数为2NA
B.100 g 46%的乙醇水溶液中,含O—H键的数目为NA
C.48 g正丁烷和10 g异丁烷的混合物中共价键数目为11NA
D.含0.3 mol NH4NO3与a mol NH3·H2O的中性溶液中含0.3NA个NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氯喹是一种抗疟药物,被WHO支持用于新冠肺炎患者临床研究。某研究小组设计如下合成路线:
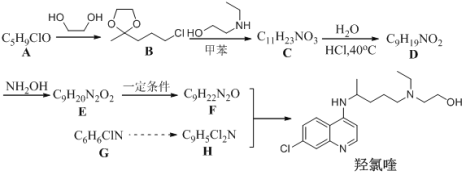
已知:
①
② ![]()
③
④苯环上连卤原子时,发生再取代反应主要生成邻、对位产物。
按要求回答下列问题:
(1)化合物A所含官能团的名称为___________________,化合物C的结构简式_______。
(2)下列说法正确的是___________________。
A. A到D过程中,乙二醇的作用是作为保护基团
B. 从合成路线推测,化合物B要密封干燥保存
C. E→F为加成反应
D. 羟氯喹的分子式为C18H26ClN3O
(3)D→E的化学方程式为____________________________。
(4)设计以苯为原料合成化合物G(用流程图表示,无机试剂任选)______________。
(5)写出同时符合下列条件的H的同分异构体的结构简式(不考虑立体异构):_______________。
1H-NMR和IR谱检测表明:
①苯环上有两种环境的不同氢,且两种氢的比例为2:1;②分子中含有氰基(-CN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列小题。
(1)某有机物X含有C、H元素,可能含有O元素。取0.46g X在氧气中完全燃烧,将燃烧后的产物依次通过浓硫酸和碱石灰,测得浓硫酸增重0.54g,碱石灰增重0.88g。由实验分析计算可得X的____(填“实验式”、“分子式”或“结构简式”)为____。
(2)有机物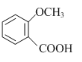 含有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:____。①能发生银镜反应;②与FeCl3发生显色反应;③苯环上的一元取代物只有1种
含有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:____。①能发生银镜反应;②与FeCl3发生显色反应;③苯环上的一元取代物只有1种
(3)化合物D是合成神经保护剂依那朵林的中间体,合成路线如下:
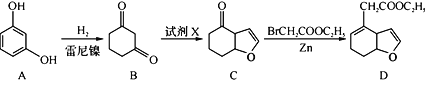
请写出以![]() 和BrCH2COOC2H5为原料制备
和BrCH2COOC2H5为原料制备![]() 的合成路线流程图(无机试剂任用。合成示例例见本题题干)____。
的合成路线流程图(无机试剂任用。合成示例例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和NH3.H2O反应的中和热ΔH=2(-57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)可表示为( )
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)可表示为( )
A. v(NH3)=0.010mol/(L·s) B. v(O2)=0.0010mol/(L·s)
C. v(NO)=0.0010 mol/(L·s) D. v(H2O)=0.45 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
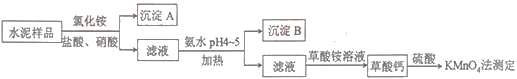
回答下列问题:
(1)沉淀A的主要成分是__。
(2)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__,请写出相应的离子方程式:__。
(3)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,实验中称取0.400g水泥样品,滴定时消耗了0.0500molL-1KMnO4溶液36.00mL。
①请配平此滴定过程中的反应。
___MnO![]() +___H++___H2C2O4——___Mn2++___CO2+___H2O
+___H++___H2C2O4——___Mn2++___CO2+___H2O
②求该水泥样品中钙的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硝酸具有强氧化性。
①把铜粉和铁粉混合物加入热的浓硝酸中,充分反应后,溶液中有铜剩余,则溶液中存在的金属阳离子为___。
②某稀硫酸与稀硝酸的混合溶液中,c(SO42-)+c(NO3-)=3.0mol·L-1。取200mL该混合酸,能溶解铜的最大质量为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com