
【题目】浓硝酸具有强氧化性。
①把铜粉和铁粉混合物加入热的浓硝酸中,充分反应后,溶液中有铜剩余,则溶液中存在的金属阳离子为___。
②某稀硫酸与稀硝酸的混合溶液中,c(SO42-)+c(NO3-)=3.0mol·L-1。取200mL该混合酸,能溶解铜的最大质量为___。
【答案】Fe2+、Cu2+ 23.04g
【解析】
①把铜粉和铁粉混合物加入热的浓硝酸中,铜和铁均与热浓硝酸反应,生成硝酸铜和硝酸铁,若铁过量还会生成硝酸亚铁,据此分析;
②依据物质的量的相关计算分析。
①把铜粉和铁粉混合物加入热的浓硝酸中,铜和铁均与热浓硝酸反应,生成硝酸铜和硝酸铁,若铁过量还会生成硝酸亚铁,则溶液中可能存在的金属阳离子为Fe2+、Fe3+、Cu2+,但溶液中有铜剩余,铜会与Fe3+反应生成Fe2+,则溶液中存在的金属阳离子为Fe2+、Cu2+,
故答案为:Fe2+、Cu2+;
②某稀硫酸与稀硝酸的混合溶液 中,c(SO42-)+c(NO3-)=3.0mol·L-1,取200mL该混合酸,加入铜,反应的离子方程式为:3Cu+2NO3+8H+=3Cu2++2NO↑+4H2O,要使溶解铜的质量最大,则氢离子和硝酸根浓度满足化学计量数4:1,硝酸全部起氧化剂作用,设硫酸浓度为x,则硝酸浓度为:3.0mol/Lx,溶液中氢离子浓度共:2x+(3.0mol/Lx),
则![]() ,
,
解得:x=1.8mol/L,
则硝酸浓度为:3.0mol/Lx=1.2mol/L,硝酸的物质的量为:0.2L×1.2mol/L=0.24mol,
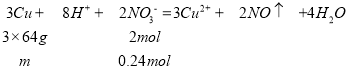
则能溶解铜的最大质量为:![]() ,
,
故答案为:23.04g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:![]()
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:![]()
D.最高价氧化物的水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
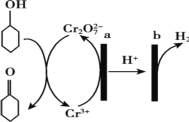
A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn与硝酸反应时,硝酸溶液的浓度不同,产物也不相同。与不同浓度硝酸反应时,反应的Zn与被还原硝酸的物质的量关系如图。还原产物为NH4NO3的曲线是( )
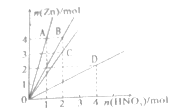
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要肥料。
(1)A的原子最外层共有___种不同运动状态的电子,该原子共有___种不同能量的电子,能量最高的电子占有___个轨道,其电子云形状为____。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,该化合物在实验室制备乙酸乙酯时所起的作用:_____。
(3)B与C元素形成带一个单位正电荷的离子,写出该微粒的电子式____。
(4)元素A与元素D相比,非金属性较强的是____(用元素符号表示),下列表述中能表明这一事实的是____。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
从原子结构分析A和D非金属强弱的原因_____。
(5)C原子的原子结构示意图:_____,C的氢化物固态时属于____晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的NaHCO3分为三等份,第一份直接加入盐酸中,消耗盐酸物质的量为n1,第二份首先加热,使其完全分解后,再加入盐酸中,消耗盐酸物质的量为n2,第三份首先加热,使其部分分解后,再加入盐酸中,消耗盐酸物质的量为n3,假若与盐酸都完全反应,则n1、n2、n3的大小关系正确的是( )
A. n1=n2=n3 B. n2>n1>n3 C. n1>n2>n3 D. n1>n3>n2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Kw=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7molL-1,则该溶液
A. 呈酸性 B. 呈碱性 C. 呈中性 D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以碘为原料,通过电解制备 KIO3 的实验装置如右图所示。电解前,先将一定量的精制碘溶于过 量 KOH 溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入某电极区。将 KOH 溶液加入另一电极区,电解槽用水冷却。下列说法不正确的是
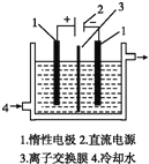
A.产品 KIO3 在阳极区得到B.离子交换膜为阴离子交换膜
C.电解时,须不断补充 KOHD.阴极区加入的是 KOH 溶液,发生还原反应生成 H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D的单质颜色相同的淡黄色固态化合物。试根据以上叙述回答:
(1)写出AB2的电子式:______________;
(2)用电子式表示C2B的形成过程:__________________________________。
(3)写出淡黄色固态化合物与水反应的化学方程式:_______________________________。
(4)请设计简单实验,比较元素B、D的金属性(或非金属性)强弱:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com