
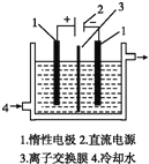
����Ŀ���Ե�Ϊԭ�ϣ�ͨ������Ʊ� KIO3 ��ʵ��װ������ͼ��ʾ�����ǰ���Ƚ�һ�����ľ��Ƶ����ڹ� �� KOH ��Һ���ܽ�ʱ������Ӧ��3I2+6KOH=5KI+KIO3+3H2O��������Һ����ij�缫������ KOH ��Һ������һ�缫����������ˮ��ȴ������˵������ȷ����
A.��Ʒ KIO3 ���������õ�B.���ӽ���ĤΪ�����ӽ���Ĥ
C.���ʱ���벻�ϲ��� KOHD.������������� KOH ��Һ��������ԭ��Ӧ���� H2
���𰸡�C
��������
������Դ����������Ϊ������ʧ���ӷ���������Ӧ����װ�����Ʊ�KIO3�������������������Һ��I2��KOH��Ӧ�����Һ����������I����������KIO3���Ҳ����Դ��������Ϊ�������������KOH��Һ��ˮ������������ӱ���ԭ����������
A����ƷKIO3Ϊ���������������������������Ӧ�����Բ�ƷKIO3���������õ�����A��ȷ��
B���������������ĵ缫��ӦʽΪI��+6OH��-6e��=IO![]() +3H2O����Ҫ������OH���ƶ���������ͬʱҪ��ֹ�������ļ����ӽ������������Խ���ĤΪ�����ӽ���Ĥ����B��ȷ��
+3H2O����Ҫ������OH���ƶ���������ͬʱҪ��ֹ�������ļ����ӽ������������Խ���ĤΪ�����ӽ���Ĥ����B��ȷ��
C�����ʱ����ˮ������������ӷŵ����������ͬʱ���������������Բ��ò���KOH����C����
D�����ݷ�����֪������������� KOH ��Һ��ˮ������������ӷ�����ԭ��Ӧ������������D��ȷ��
�ʴ�ΪC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
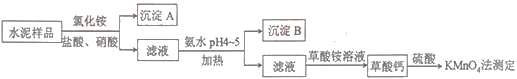
����Ŀ��ˮ������Ҫ�Ľ������ϡ�ˮ�����ϵ���Ҫ�ɷ�ΪCaO��SiO2��������һ��������������þ�Ƚ����������ʵ���Ҳⶨˮ����Ʒ�иƺ����Ĺ�����ͼ��ʾ��
�ش��������⣺
��1������A����Ҫ�ɷ���__��
��2���ڷֽ�ˮ����Ʒ�����У�������Ϊ�ܼ����Ȼ��Ϊ���ܼ���������뼸�����ᡣ���������Ŀ����__����д����Ӧ�����ӷ���ʽ��__��
��3������Ƴ�����ϡH2SO4��������KMnO4����Һ�ζ���ͨ���ⶨ��������ɼ�ӻ�֪�Ƶĺ�����ʵ���г�ȡ0.400gˮ����Ʒ���ζ�ʱ������0.0500molL-1KMnO4��Һ36.00mL��
������ƽ�˵ζ������еķ�Ӧ��
___MnO![]() +___H++___H2C2O4����___Mn2++___CO2+___H2O
+___H++___H2C2O4����___Mn2++___CO2+___H2O
�����ˮ����Ʒ�иƵ���������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�������ǿ�����ԡ�
�ٰ�ͭ�ۺ����ۻ��������ȵ�Ũ�����У���ַ�Ӧ����Һ����ͭʣ�࣬����Һ�д��ڵĽ���������Ϊ___��
��ijϡ������ϡ����Ļ����Һ�У�c(SO42-)+c(NO3-)=3.0mol��L-1��ȡ200mL�û���ᣬ���ܽ�ͭ���������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ������ͼװ�öԵ绯ѧԭ��������һϵ��̽�����
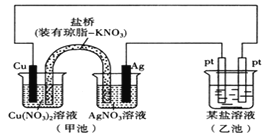
��1���׳�Ϊװ��__���ԭ��ء����ء�����
��2���׳ط�Ӧǰ�����缫������ȣ�һ��ʱ������缫�������28g��������ͨ��__mol���ӡ�
��3��ʵ������У��׳�����ձ���NO3-��Ũ��__����������С�����䡱����
��4�������������䣬����U��ͭ�����桰���š�������һ��ʱ���ȡ��U��ͭ������������___����������С�����䡱����
��5�����ҳ��е�ij����Һ������AgNO3��Һ�����ҳ������Pt�缫��ӦʽΪ___������һ��ʱ�����Ҫʹ�ҳ���Һ�ָ�ԭ��Ũ�ȣ�������Һ�м���___���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ����仯����˵��������ȷ����
A.�����귢ׯ���������ڷŵ���������������̬�ĵ�ת��Ϊ����̬
B.���������������γ����꣬������һ�������´ٽ��γ����⻯ѧ������
C.�̬����Ӧ����������������̬����(������)���ܹ�����
D.��ҵ���Ʊ���������У����������ų������ȣ���Ԥ���½����豸�İ����Ϳ�������Լ��Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��� 5 L �ĺ����ܱ������з�����ӦN2(g)+3H2(g)2NH3(g)����Ӧ�����еIJ����������±���ʾ��
n/mol t/min | N(N2) | N(H2) | N(NH3) |
0 | a | 24 | 0 |
5 | 13 | 6 | |
10 | 12 | ||
15 | 8 |
����˵����ȷ����
A.N2 �ij�ʼŨ��Ϊ16 mol��L1
B.0��5 min ��H2��ʾ��ƽ����Ӧ����Ϊ0.24 mol��L1��min1
C.ƽ��״̬ʱ��c(N2)��2.6 mol��L1
D.N2 ��ƽ��ת����Ϊ 25%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ֵ���ɫ����,�����������̼��Ӧ��������,��DZˮͧ������������,���������֮��.���������̼��Ӧ�Ļ�ѧ����ʽΪ: 2Na2O2 + 2CO2 == 2Na2CO3 + O2��ijѧ��Ϊ����֤��һʵ�飬�������Ĵ���ʯ�������������������Ϊԭ�ϣ���ȡO2����Ƴ�����ʵ��װ�ã�

��1��A����ȡCO2 ��װ�ã�Ӧ������ͼ������ ��ѡ�ĸ�ͼ��________��

Aװ���з�����Ӧ�����ӷ���ʽΪ ______________________________��
��2��Bװ�õ�������________________��Cװ���ڿ��ܳ��ֵ�������__________ ��Ϊ�˼���E���ռ��������壬��ȡ������ƿ��__________________________����Ҫ�����������̼����ۣ���
��3����E�е�ʯ��ˮ��������ɫ���ǣ���˵��ԭ��_______________ �������ӷ���ʽ����Ҫ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������������ʱ��ͬʱʵ�־����л�����ˮ��������![]() ��ˮ(pHԼΪ6)�͵���ʳ��ˮ����װ��ʾ��ͼ��ͼ��ʾ��ͼ�У�D��EΪ���ӽ���Ĥ��ZΪ������ʳ��ˮ��(��֪Cr3+��ȫ���������pHΪ5.6)����˵������ȷ����
��ˮ(pHԼΪ6)�͵���ʳ��ˮ����װ��ʾ��ͼ��ͼ��ʾ��ͼ�У�D��EΪ���ӽ���Ĥ��ZΪ������ʳ��ˮ��(��֪Cr3+��ȫ���������pHΪ5.6)����˵������ȷ����
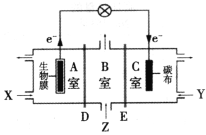
A.EΪ�����ӽ���Ĥ
B.XΪ�л�����ˮ��YΪ��![]() ��ˮ
��ˮ
C.�����ϴ���1 mol��![]() ��ͬʱ���ѳ�3 mol��NaC1
��ͬʱ���ѳ�3 mol��NaC1
D.C�ҵĵ缫��ӦʽΪ![]() +6e-+8H+==2Cr(OH)3��+H2O
+6e-+8H+==2Cr(OH)3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A��B����ѧ���������ʣ����������ӿɴӱ���ѡ��.
������ | K+��Na+��NH4+��Fe2+��Ba2+��Cu2+ |
������ | OH����I����NO3����AlO2����HCO3����HSO4�� |
��1����A��ˮ��ҺΪ��ɫ��B��ˮ��Һ�ʼ��ԣ�A��B��ˮ��Һ��Ϻ�ֻ����������ϡ����İ�ɫ��������ʹʪ��ĺ�ɫʯ����ֽ���������壬��:
��A�еĻ�ѧ������Ϊ_________���������Ӽ����������ۼ�������
��A��B��Һ��Ϻ���ȳ����ԣ��÷�Ӧ�����ӷ���__________________________ ��
��2����A��ˮ��ҺΪdz��ɫ��B����ɫ��Ӧ�ʻ�ɫ����A��ˮ��Һ�м���ϡ���������������ټ���B����Һ��ƣ���A��B��ˮ��Һ��Ϻ������Ա仯����
��A�Ļ�ѧʽΪ__________________________ ��
�ھ�����������������Һ��Ƶ�ԭ����������֣���������������
��._______________________����._________________________��
������һ������֤��������Һ��Ƶ�ԭ��_________________________��
������������������Һ���ԭ����������Ƴ�ԭ��أ���������a����b����b���ĵ缫��ӦʽΪ_��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com