
����Ŀ����A��B��C��D���ֶ�����Ԫ�أ����ǵ�ԭ��������A��D����������֪A��Bԭ������ͬ�ĵ��Ӳ�������A��L���������K���������������Cȼ��ʱ���ֻ�ɫ���棬C�ĵ����ڵ�ȼ��������B�ĵ��ʳ�ַ�Ӧ�����Եõ���D�ĵ�����ɫ��ͬ�ĵ���ɫ��̬������Ը������������ش�
(1)д��AB2�ĵ���ʽ��______________��
(2)�õ���ʽ��ʾC2B���γɹ��̣�__________________________________��
(3)д������ɫ��̬��������ˮ��Ӧ�Ļ�ѧ����ʽ��_______________________________��
(4)����Ƽ�ʵ�飬�Ƚ�Ԫ��B��D�Ľ�����(��ǽ�����)ǿ����________________��
���𰸡�![]()
![]() 2Na2O2+2H2O==4NaOH+O2�� ��ʢ��Na2S��Һ���Թ���ͨ������O2�������ֵ���ɫ�����������ķǽ����Դ�����
2Na2O2+2H2O==4NaOH+O2�� ��ʢ��Na2S��Һ���Թ���ͨ������O2�������ֵ���ɫ�����������ķǽ����Դ�����
��������
A��B��C��D���ֶ�����Ԫ�أ����ǵ�ԭ��������A��D��������A��L���������K�����������������A��2�����Ӳ㣬L�������Ϊ4��AΪ̼Ԫ�أ�C����ȼ��ʱ���ֻ�ɫ���棬��CΪ��Ԫ�أ� C�ĵ����ڵ�ȼʱ��������B���ʳ�ַ�Ӧ�����Եõ���D������ɫ��ͬ�ĵ���ɫ��̬�����A��Bԭ������ͬ�ĵ��Ӳ�������A��B����ͬһ���ڣ���BΪ��Ԫ�ء�DΪ��Ԫ�أ��ݴ˷������
��������������AΪ̼Ԫ�أ�BΪ��Ԫ�أ�CΪ��Ԫ�أ�DΪ��Ԫ�ء�
(1)AB2ΪCO2��CO2������̼ԭ������ԭ���γ�2�Թ��õ��Ӷԣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2) C2BΪNa2O��Ϊ���ӻ�����õ���ʽ��ʾNa2O���γɹ��̱�ʾΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3)����ɫ��̬������Ϊ�������ƣ�����������ˮ��Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2H2O==4NaOH+O2�����ʴ�Ϊ��2Na2O2+2H2O==4NaOH+O2����
(4)�Ƚ�Ԫ��O��S�Ľ�����(��ǽ�����)ǿ�������Ը����û���Ӧ���ʵ�飬ʵ�鷽��Ϊ����ʢ��Na2S��Һ���Թ���ͨ������O2�������ֵ���ɫ�����������ķǽ����Դ����ʴ�Ϊ����ʢ��Na2S��Һ���Թ���ͨ������O2�������ֵ���ɫ�����������ķǽ����Դ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��̽��0.25mol/L Al2( SO4)3��Һ��0.5mol/L Na2CO3��Һ�ķ�Ӧ��ʵ�����£�

���з�������ȷ����
A. ʵ��I�У���ɫ����a��Al(OH)3
B. ʵ��2�У���ɫ����b����CO32-
C. ʵ��l��2�У���ɫ�����ɷֲ�ͬ��ԭ�����Ϻ���Һ��pH��
D. �����ɫ����a��b���ϴ�Ӹɾ��������������ữ��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ��ķ�Ӧ���£�3H2+N2![]() 2NH3��ij�¶��£����ݻ��㶨Ϊ2.0 L���ܱ������г���2.0 mol N2��2.0 mol H2��һ��ʱ���Ӧ��ƽ��״̬��ʵ���������±���ʾ��
2NH3��ij�¶��£����ݻ��㶨Ϊ2.0 L���ܱ������г���2.0 mol N2��2.0 mol H2��һ��ʱ���Ӧ��ƽ��״̬��ʵ���������±���ʾ��
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0��50 s�ڵ�ƽ����Ӧ���� v(N2)��_______________��
(2)250 sʱ��H2��ת����Ϊ________��
(3)��֪N��N�ļ���Ϊ946 kJ��mol-1��H��H�ļ���Ϊ436 kJ��mol-1��N��H�ļ���Ϊ391 kJ��mol-1��������1 mol NH3�����е������仯Ϊ_______kJ����ͼ����ȷ��ʾ�÷�Ӧ�������仯����_____(����ĸ)��
A��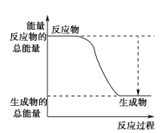 B��
B��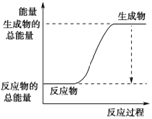
(4)Ϊ�ӿ췴Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ__________��
a�������¶ȣ�b������ѹǿ��c������ʱ����He����d����ѹʱ����He����e����ʱ�����NH3
(5)���п��жϷ�Ӧ�Ѵﵽƽ��״̬����__________��
A �����ƽ��Ħ����������
B N2��H2�ķ�Ӧ���ʱ�Ϊ1:3
C ���������ܶȲ���
D ����1mol N2��ͬʱ����2mol NH3
E N2��H2��NH3���ʵ���֮�ȵ���ϵ����
F ����������ѹǿ���ٷ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��Ϸ�ĩ17.6 g���뵽800mL 1.0mol/L�� FeCl3��Һ�У���ַ�Ӧ��������Һ��Fe2+��Cu2+���ʵ���Ũ��֮��Ϊ8��1�������й�˵����ȷ����
A. ��Ϸ�ĩ������ͭ�����ʵ���֮����1��2
B. ��Ӧ�����Һ�������ܽ�����5.6g
C. ��Ӧ��������Һ��c(Fe2+)=1.0mol/L (���跴Ӧǰ����Һ����ޱ仯)
D. ��Ӧ�����Һ�м���2.0 mol/L NaOH��Һ����������ǡ��ȫ������ʱ�������NaOH��Һ�������1.6 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������CO2����ͨ��KOH��Ba(OH)2��KAlO2�Ļ����Һ�У����ɳ��������ʵ�������ͨ��CO2�������ϵ��ͼ��ʾ�����й���������Ӧ�����е������������

A. Oa�η�Ӧ�Ļ�ѧ����ʽ��Ba(OH)2��CO2 =BaCO3����H2O
B. bc����cd��������CO2�������ͬ
C. bc�η�Ӧ�����ӷ���ʽ��2AlO2-��3H2O��CO2 = 2Al(OH)3����CO32-
D. de�γ�������������BaCO3�������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���������������������װ��![]() ����ͼ
����ͼ![]() �Ի�����Ϊԭ���Ʊ�����ϩ��
�Ի�����Ϊԭ���Ʊ�����ϩ��

��֪��
�ܶȣ�g/cm3�� | �۵㣨�棩 | �е㣨�棩 | �ܽ��� | |
������ | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | ��103 | 83 | ������ˮ |
��1���Ʊ���Ʒ��12.5mL�����������Թ�A�У��ټ���1 mLŨ���ᣬҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
��A�����Ƭ��������________������B���˵�������е�������_________��
���Թ�C���ڱ�ˮԡ�е�Ŀ����________________��
��2���Ʊ���Ʒ
�ٻ���ϩ��Ʒ�к��л������������������ʵȡ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��____�㣨��ϡ����¡�������Һ����________�������ţ�ϴ�ӡ�
a.KMnO4��Һ b.ϡH2SO4 c.Na2CO3��Һ
���ٽ�����ϩ����ͼװ��������ȴˮ��________�ڽ��롣����ʱҪ������ʯ�ң�Ŀ����__________________________��

���ռ���Ʒʱ�����Ƶ��¶�Ӧ��______���ң�ʵ���ƵõĻ���ϩ��Ʒ�����������۲��������ܵ�ԭ����______��
a.����ʱ��70�濪ʼ�ռ���Ʒ
b.������ʵ����������
c.�Ʊ���Ʒʱ���������Ʒһ������
(3)�������ֻ���ϩ��Ʒ�ʹ�Ʒ�ķ�������������_______��
a.�����Ը��������Һ b.�ý����� c.�ⶨ�е�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����淴Ӧ2A(g)+3B(s)![]() 2C(g)�ﵽƽ��ı�־��( )
2C(g)�ﵽƽ��ı�־��( )
A. A��B��C��Ũ�����
B. ����ƽ��Ħ����������ʱ��ı���ı�
C. A��B��C�ķ�������Ϊ1��3��2
D. ����������ʵ�������ʱ��ı���ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Co��Cu��Zn���ǹ���Ԫ�أ�����Ϊ����ԭ���γɶ����������в�����Ϊ�������λ�����______��
A��H2O B��NH3 C��CH4 D��Cl��
��2���������ʾʽд����ˮ��NH3������ˮ���Ӽ���ܴ��ڵ����____��
��3��CuԪ�ؿ��γ�[Cu(NH3)4]SO4�����д��ڵĻ�ѧ��������______������ţ���
����λ���� ������� �ۼ��Թ��ۼ����ܷǼ��Թ��ۼ� �����Ӽ���
��4�����龧��ľ����ṹ����ͼ�������й�˵����ȷ����_______��
A�������ڳ����³���̬��˵�����龧�����ڷ��Ӿ���
B��������1��CH4������12�����ڵļ������
C��CH4�����ۻ�ʱ��˷����ۼ�

��5����ͼ��ʾ����SiO2�ľ����ṹ����Ȧ������ԭ�ӣ��ڵ������ԭ�ӣ����ж���30g�������辧���к�______mol Si��O���������������ı߳�Ϊa cm����NA ��ʾ�����ӵ���������SiO2������ܶȱ���ʽΪ__________________g/cm3 ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com