
【题目】(1)Co、Cu、Zn都是过渡元素,可作为中心原子形成多种配合物,下列不能作为配合物配位体的是______;
A.H2O B.NH3 C.CH4 D.Cl﹣
(2)用氢键表示式写出氨水中NH3分子与水分子间可能存在的氢键____;
(3)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有______(填序号);
①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
(4)甲烷晶体的晶胞结构如下图,下列有关说法正确的是_______。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键

(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含______mol Si-O键。如果该立方体的边长为a cm,用NA 表示阿伏加德罗常数,则SiO2晶体的密度表达式为__________________g/cm3 。

【答案】C N—H…O O—H…N①③⑤AB2 mol480/(NA·a3)
【解析】
(1)A.H2O是共价化合物,是由原子和氢原子形成共价键,电子式为![]() ,有孤对电子,可以作为配体,故A不选;B.NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为
,有孤对电子,可以作为配体,故A不选;B.NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为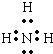 ,有孤对电子,可以作为配体,故B不选;C.碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为
,有孤对电子,可以作为配体,故B不选;C.碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为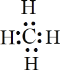 ,无孤对电子,不可以作为配体,故C正确;D.Cl-为氯原子得到1个电子形成的阴离子,电子式为
,无孤对电子,不可以作为配体,故C正确;D.Cl-为氯原子得到1个电子形成的阴离子,电子式为![]() ,有孤对电子,可以作为配体,故D不选;故选C。
,有孤对电子,可以作为配体,故D不选;故选C。
(2)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N,氨水中NH3分子与水分子间形成的可能存在的氢键N-H…O、O-H…N;
(3)[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与SO42-之间的化学键为离子键,[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,[Cu(NH3)4]SO4,因此,本题正确答案是:①③⑤;
(4)A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体,分子晶体间的作用力为分子间作用力,故A正确;B. 以该甲烷晶胞为单元,位于顶点的某1个甲烷分子与其距离最近的甲烷分子有3个,而这3个甲烷分子在面心上,因此每个都被共用2次,故与1个甲烷分子紧邻的甲烷分子有3×8×![]() =12个,故B正确;C. 甲烷是分子晶体,熔化时需克服范德华力,故C错误;故选AB;
=12个,故B正确;C. 甲烷是分子晶体,熔化时需克服范德华力,故C错误;故选AB;
(5)一个硅原子连四个O,所以就有四个硅氧,即1mol SiO2含4mol硅氧键,30g二氧化硅为0.5mol, 30g二氧化硅中的含有0.5mol×4=2mol Si-O键;由晶胞图可得出Si原子个数为![]() ;一个晶胞中有8个SiO2分子,1mol SiO2的质量为60g,一个晶胞的质量为
;一个晶胞中有8个SiO2分子,1mol SiO2的质量为60g,一个晶胞的质量为![]() ,除以体积得出密度为480/(NA·a3) g/cm3。
,除以体积得出密度为480/(NA·a3) g/cm3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到与D的单质颜色相同的淡黄色固态化合物。试根据以上叙述回答:
(1)写出AB2的电子式:______________;
(2)用电子式表示C2B的形成过程:__________________________________。
(3)写出淡黄色固态化合物与水反应的化学方程式:_______________________________。
(4)请设计简单实验,比较元素B、D的金属性(或非金属性)强弱:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,将等体积的盐酸和氨水混和后,所得溶液的pH=7,则下列说法正确的是
A.原来盐酸的物质的量浓度等于氨水的物质的量浓度
B.所得溶液中c(NH4+)=c(Cl—)
C.所得溶液中c(NH4+)+c(H+)=c(Cl—)
D.所得溶液中c(NH4+)+c(NH3·H2O)=c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期元素主族,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物。
(1)写出X2Z2的电子式_________,Y单质分子的结构式____________。
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的分子式是_____________。
(3)写出由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子,阳离子_____阴离子______。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4∶2∶3,该盐的化学式是_____。X、Y也能形成一种盐,X、Y元素的原子个数比为5∶1,则该盐的化学式为 ______________________________
(5)下列说法正确的是(____)
a.氢化物热稳定性:Y>Z
b.氢化物的熔沸点:Y>Z
c.原子半径:Y>Z
d.Z的氢化物的熔沸点比同主族其他物质的高,是因为分子内形成了氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为
①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6
A. ①②④⑤ B. ①②③⑤ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向浓度均为0.10mol/L、体积均为1mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至VmL,两种溶液的pH与lgV的变化关系如图所示。下列叙述中错误的是
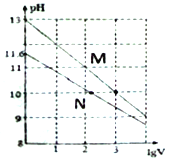
A. Ka1(CO32-)(Ka1为第一级水解平衡常数)的数量级为10-4
B. 曲线N表示Na2CO3溶液的pH随lgV的变化关系
C. Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D. 若将Na2CO3溶液加热蒸干,由于CO32-水解,最终析出的是NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列说法正确的是( )
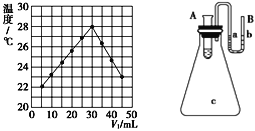
图1 图2
A. 据图1可知实验时的环境温度等于22 ℃。
B. 据图1可知该NaOH溶液的物质的量浓度为3.0molL-1
C. 图2,如果在装有水的小试管中分别加入烧碱固体、浓硫酸、硝酸铵固体都能使a端液面高于b端液面
D. 若溶液比热容近似为4.18 J/(g℃),溶液密度近似为1g/mL。则该反应的中和热的数值为125.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是
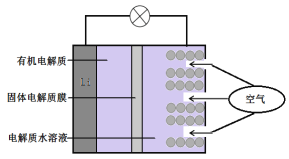
A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com