
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.金属和一定量的任意酸反应,只要放出2 g氢气,则转移的电子数为2NA
B.100 g 46%的乙醇水溶液中,含O—H键的数目为NA
C.48 g正丁烷和10 g异丁烷的混合物中共价键数目为11NA
D.含0.3 mol NH4NO3与a mol NH3·H2O的中性溶液中含0.3NA个NH![]()
【答案】D
【解析】
A.若一定量的浓硫酸和金属反应,开始时产生二氧化硫,当浓硫酸变稀后才生成氢气,此时放出2g氢气时,转移的电子数不是2NA,故A错误;
B.100 g 46%的乙醇水溶液中乙醇的质量为为46g,物质的量为1mol;水的质量为54g,物质的量为3mol; 1mol乙醇所含O—H键的数目为NA,但3mol水中还有6molO—H键,故B错误;
C.正丁烷和异丁烷的摩尔质量均为58g/mol,故48 g正丁烷和10 g异丁烷的混合物即共58g混合物的物质的量为1mol,且两者结构中均含13个共价键,故1mol混合物中含共价键为13NA,故C错误;
D.溶液中存在电荷守恒c(NH![]() )+c(H+)= c(NO
)+c(H+)= c(NO![]() )+c(OHˉ),溶液显中性,所以c(H+)= c(OHˉ),则c(NH
)+c(OHˉ),溶液显中性,所以c(H+)= c(OHˉ),则c(NH![]() )= c(NO
)= c(NO![]() ),即n(NH
),即n(NH![]() )= n(NO
)= n(NO![]() ),0.3 mol NH4NO3中n(NO
),0.3 mol NH4NO3中n(NO![]() )=0.3mol,所以溶液中n(NH
)=0.3mol,所以溶液中n(NH![]() )=0.3mol,即0.3NA,故D正确;
)=0.3mol,即0.3NA,故D正确;
故答案为D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
(3)下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
(4)工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2﹣+NO3﹣+H2O和NO+NO2+2OH﹣=__+H2O(配平该方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型,请回答下列问题:

(1)向丙中加入溴水,振荡静置后,观察到溶液分层,上层为_______色。
(2)甲的同系物的通式为CnH2n+2,当n=5时,写出含有3个甲基的有机物的结构简式_____。
下图是用乙制备D的基本反应过程

(3)A中官能团为__________。
(4)反应①的反应类型是__________。
(5)写出反应④的化学方程式_______。
(6)现有138gA和90gC发生反应得到80gD。试计算该反应的产率为______(用百分数表示,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.FeCl3溶液和Cu混合:FeCl3+Cu = Fe2++Cu2+ +3Cl-
B.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH﹣![]() HCOO﹣+NH
HCOO﹣+NH![]() +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
C.碳酸氢钠的水解方程式:HCO![]() +H2O
+H2O![]() CO
CO![]() +H3O+
+H3O+
D.Ca(HCO3)2溶液中加入过量氨水:Ca2++2HCO![]() +2NH3H2O=CaCO3↓+2H2O+2NH
+2NH3H2O=CaCO3↓+2H2O+2NH![]() +CO
+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
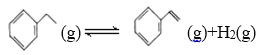
一段时间后,反应达到平衡,反应过程中测定的部分数据如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是
A.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0%
B.反应在前20 min内的平均反应速率v(H2)=0.008 mol·L-1·min-1
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,体系的总压增大,平衡时苯乙烷的分压也增加。
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,则达到平衡前:v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
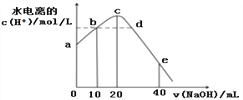
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:![]()
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:![]()
D.最高价氧化物的水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮(![]() )在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
)在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。下列说法正确的是
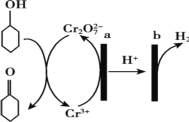
A.a 极与电源负极相连
B.a 极电极反应式是 2Cr3+- 6e- +14OH-= Cr2O72-+7H2O
C.b 极发生氧化反应
D.理论上生成 1mol 环己酮时,有 1molH2 生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com