
科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
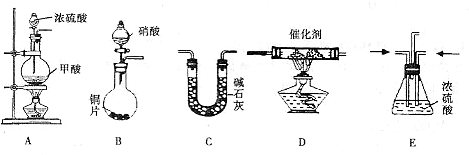
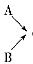 ( )→( )→( )→收集气体
( )→( )→( )→收集气体| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
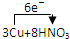 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃河西五市高三第一次联合考试化学试卷(解析版) 题型:填空题
Ⅰ.A、B、C、D均是前四周期元素组成的常见不同单质或化合物。它们之间有如下转化关系:

(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式: _______???????????? __________
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是________ _______, C盐水溶液PH______7 (填“>”“<”“ =”)。
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______(填“小写”字母)。
a.A可能是一种耐火材料;
b.B的溶液一定呈碱性;
c.C 一定既溶于盐酸又溶于苛性钠溶液;?
若A为金属单质,则用1molA金属制备C,最少需_____mol HCl和_____mol NaOH。
Ⅱ.汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含有Na、Fe、N、O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲(摩尔质量为65g/ mol),加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成一种碱性氧化物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲受热分解的化学方程式为??????????????????? 。
(2)丙的电子式为??????????? 。
(3)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是??????????? 。
A.KCl??????????? B.KOH?????????? C.Na2S????????????? D.CuO
查看答案和解析>>
科目:高中化学 来源:0115 月考题 题型:填空题
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下表列出了几种物质的物理性质数据,请参考相关物质的数据合成1-溴丁烷。实验室制备1—溴丁烷的反应如下:①NaBr + H2SO4 ?= HBr + NaHSO4 ;②R—OH + HBr ![]() R—Br +H2O可能存在的副反应有:加热过程中反应混合物会呈现黄色或红棕色;醇在浓硫酸存在下脱水生成烯和醚等。请回答下列问题:
R—Br +H2O可能存在的副反应有:加热过程中反应混合物会呈现黄色或红棕色;醇在浓硫酸存在下脱水生成烯和醚等。请回答下列问题:
正丁醇 | 1-溴丁烷 | 正丁醚 | |
熔点/℃ | -89.53 | -112.4 | -98 |
沸点/℃ | 117.7 | 101.6 | 142 |
密度/g.cm-3 | 0.8098 | 1.2758 | 0.769 |
水溶性 | 微溶 | 不溶 | 不溶 |
实验一:实验室制取少量1-溴丁烷的装置如图所示。在a中,加入7.0ml正丁醇、足量的溴化钠和1:1的硫酸。
(1)写出装置图中玻璃仪器的名称:a ▲ ,b ▲ 。
(2)配制体积比1:1的硫酸所用的定量仪器为 ▲ (填字母)。
A.天平 B.量筒 C.容量瓶
(3)制备操作中,加入的浓硫酸必须进行适当的稀释,其目的是 ▲ (填字母)。
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂

实验二:先利用图甲装置把制备得到的粗产品水洗,水洗时需加入碳酸钠固体加以提纯;再利用图乙装置进行蒸馏提纯。
|
|

(4)用图甲装置进行水洗提纯时,往往要加入Na2CO3固体,其作用主要是除去 ▲ 。在图乙装置中加入适当的干燥剂,并将洗涤后的粗产品通过分液漏斗转移到图乙装置中进行蒸馏。下列可做为粗产品蒸馏提纯时的干燥剂的是 ▲ 。(填字母)
A.NaOH固体 B.碱石灰 C.无水硫酸钠 D.无水氯化钙
(5)用图乙装置进行蒸馏提纯时,当温度计显示 ▲ 时,收集1-溴丁烷。
(6)若获得了1-溴丁烷为7.0克,试计算其产率 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com