
| A. | NH3、CuS、SO2、FeS | B. | SO3、Cu2S、FeI2、FeCl3 | ||
| C. | FeCl3、SO2、NO、Cu2S | D. | FeCl2、FeS、SO2、FeI3 |
分析 A.铜和硫化合生成的是硫化亚铜,不是硫化铜;
B.硫在氧气中燃烧生成是二氧化硫,不是三氧化硫;
C.四种化合物都可以由单质通过化合反应得到;
D.Fe和氯气反应生成的是FeCl3,铁与碘单质反应生成的FeI2,不会得到FeI3.
解答 解:A.NH3、SO2、FeS可以由单质通过化合反应生成,而单质Cu、S发生化合反应生成的是Cu2S,故A错误;
B.SO3、Cu2S、FeI2、FeCl3可以由单质通过化合反应生成,而S和氧气反应生成的是SO2,故B错误;
C.FeCl3、SO2、NO、Cu2S都可以由单质通过化合反应生成,满足条件,故C正确;
D.FeS、SO2可以由单质通过化合反应生成,而Fe和I2反应生成的是FeI2,Fe和氯气反应生成的是FeCl3,故D错误;
故选C.
点评 本题考查了常见金属元素单质及其化合物性质,题目难度中等,明确常见金属单质及其化合物的性质为解答关键,注意Fe与S、I2单质反应生成的分别为FeS、FeI2,试题有利于培养学生的灵活应用能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2017届江苏省南通市如东县徐州市丰县高三10月联考化学卷(解析版) 题型:实验题
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1)工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是 。

(2)实验室模拟工业二氧化锰制备硫酸锰装置如图
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。

查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:填空题
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为 : 、 。
(3)精制饱和食盐水从图 中________位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“ c”或“d”)
c”或“d”)

(4)KClO3可 以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 。
(5)室温下,0.1mol/LNaClO溶液的pH 0.1 mol/LNa2SO3溶液的pH。(选填“大于”、“小于”或“等于”)
(6)浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol•L-1 | B. | 0.8mol•L-1 | C. | 1.0mol•L-1 | D. | 1.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
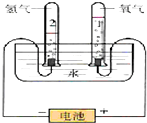 水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.
水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图. .
.| 质 量 | 物质的量 | O2与H2的体积比(同温同压下) | |
| O2 | 3.2g | 0.1mol | 1:2 |
| H2 | 0.4g | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 VO2++2H++V2+..下列说法正确的是( )
VO2++2H++V2+..下列说法正确的是( )| A. | 放电时正极反应为:VO${\;}_{2}^{+}$+2H++e-═VO2++H2O | |
| B. | 充电过程中,H+由阴极区向阳极区迁移 | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电时阴极反应为:V2+-e-═V3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是组成中含有氢元素的化合物都属于酸 | |
| B. | 凡是组成中含有OH-的化合物都属于碱 | |
| C. | 酸和碱中至少含有一种相同的元素 | |
| D. | 酸和碱中都含有金属阳离子和阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com