
【题目】SO2 既有氧化性又有还原性,还有漂白性。下列对它变化中表现的性质标注正确的是( )
①SO2使溴水褪色(氧化性)
②SO2使品红溶液褪色(漂白性)
③SO2通入氢硫酸(H2S)产生淡黄色浑浊(还原性)
④SO2使润湿的蓝色石蕊试纸变红(水溶液酸性)
A. 只有②④ B. 只有③④ C. 只有①③ D. ①②③④
科目:高中化学 来源: 题型:
【题目】现有下列8种物质:①Na2CO3 ②NaHCO3 ③HCl ④NH4HCO3 ⑤C2H5OH ⑥Al ⑦食盐水 ⑧CH3COOH
(1)上述物质中属于强电解质的是________(填序号),属于弱电解质的是________(填序号),能跟盐酸反应又能跟NaOH溶液反应的是________(填序号)。
(2)④与足量的NaOH浓溶液在加热条件下反应的离子方程式为_________________。
(3)⑥与NaOH溶液反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液。若Cl2与KOH溶液反应时,被还原与被氧化的氯元素物质的量之比是11︰3,则混合液中ClO-与ClO3-的物质的量之比是( )
A.1︰1 B.1︰2 C.1︰3 D.2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是合成天然橡胶的单体,分子式为C5H8,A的一系列反应如下(部分反应条件略去):

已知:
回答下列问题:
(1)A的结构简式为_____________,化学名称是________________________。
(2)B的分子式为__________________________。
(3)②反应的化学方程式为_____________________________________。
(4)①和③的反应类型分别是___________、______________。
(5)C为单溴代物,分子中有两个亚甲基,④的化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A.苯与液溴反应生成溴苯属于加成反应
B.分子式为C4H9Cl的同分异构体数目有4种(不考虑立体异构)
C.葡萄糖能发生氧化反应和水解反应
D.分子组成上相差1个或多个CH2原子团的物质互称为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。下列有关分析正确的是
A.K3C60中只有离子键B.K3C60中碳元素显-3价
C.该晶体在熔融状态下能导电D.C60与12C互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·3H2O2)是由Na2CO3与H2O2复合而形成的一种固体放氧剂,同时具有Na2CO3和H2O2双重性质。可用于洗涤、纺织、医药、卫生等领域。工业上常以过碳酸钠产品中活性氧含量([O]%=![]() ×100%)来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如图:
×100%)来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如图:
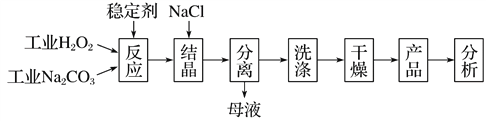
回答下列问题:
(1)过碳酸钠受热易分解,写出反应的化学方程式:_____________。
(2)稳定剂及反应温度等因素对产品质量有很大影响。
①下列试剂中,可能用作“稳定剂”的是________(填字母)。
a.MnO2 b.KI
c.Na2SiO3 d.FeCl3
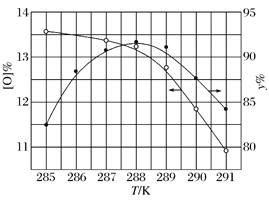
②反应温度对产品产率(y%)及活性氧含量的影响如下图所示。要使产品达到优等品且产率超过90%,合适的反应温度范围是______________。
③“结晶”时加入NaCl的目的是______________。
(3)“母液”中可循环利用的主要物质是______________。
(4)产品中活性氧含量的测定方法:称量0.160 0 g样品,在250 mL锥形瓶中用100 mL 0.5 mol·L-1硫酸溶解完全,立即用0.020 00 mol·L-1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56 mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24 mL。
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有_____________。
②该样品的活性氧含量为________% 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是我校实验室化学试剂浓硫酸标签上的部分内容。现需要 240 mL 1 mol· L-1 的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用 的仪器有:① 胶头滴管;②玻璃棒;③烧 杯;④量筒。 请回答下列问题:

(1)配制稀硫酸时,还缺少的仪器有________(写仪器名称)。
(2)该硫酸的物质的量浓度为__________ mol/L;所需浓硫酸的体积约为_______mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(3)定容时,若加入的水超过刻度线,必须采取的措施是__________
(4)下列操作对 H2SO4 的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:__________ ;
②容量瓶用水洗净后未烘干:__________ ;
③定容时俯视容量瓶的刻度线:__________ 。
(5)在配制过程中,下列操作不正确的是(填序号) __________ 。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将准确量取的 18.4mol·L-1 的硫酸,注入已盛有100mL水的500mL的容量瓶中,加水至刻度线.
D.将硫酸溶于水后需冷却至室温再转移到容量瓶中
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手掌托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com