
【题目】下图是我校实验室化学试剂浓硫酸标签上的部分内容。现需要 240 mL 1 mol· L-1 的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用 的仪器有:① 胶头滴管;②玻璃棒;③烧 杯;④量筒。 请回答下列问题:

(1)配制稀硫酸时,还缺少的仪器有________(写仪器名称)。
(2)该硫酸的物质的量浓度为__________ mol/L;所需浓硫酸的体积约为_______mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(3)定容时,若加入的水超过刻度线,必须采取的措施是__________
(4)下列操作对 H2SO4 的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:__________ ;
②容量瓶用水洗净后未烘干:__________ ;
③定容时俯视容量瓶的刻度线:__________ 。
(5)在配制过程中,下列操作不正确的是(填序号) __________ 。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将准确量取的 18.4mol·L-1 的硫酸,注入已盛有100mL水的500mL的容量瓶中,加水至刻度线.
D.将硫酸溶于水后需冷却至室温再转移到容量瓶中
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手掌托住瓶底,把容量瓶倒转摇匀
【答案】 250mL 容量瓶 18.4 13.6 > 重新配制 偏低 无影响 偏高 BCE
【解析】试题分析:本题考查物质的量浓度与溶质质量分数的换算,一定体积物质的量浓度溶液的配制和误差分析。
(1)配制240mL溶液选用250mL容量瓶,由浓硫酸配制稀硫酸需要的仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,缺少的仪器为250mL容量瓶。
(2)根据公式c=![]() ,该硫酸物质的量浓度为
,该硫酸物质的量浓度为![]() =18.4mol/L。根据c(浓硫酸)V(浓硫酸)=c(稀硫酸)V(稀硫酸),V(浓硫酸)=1mol/L
=18.4mol/L。根据c(浓硫酸)V(浓硫酸)=c(稀硫酸)V(稀硫酸),V(浓硫酸)=1mol/L![]() 250mL
250mL![]() 18.4mol/L=13.6mL。硫酸溶液随着浓度的增大密度逐渐增大,ρ(水)
18.4mol/L=13.6mL。硫酸溶液随着浓度的增大密度逐渐增大,ρ(水)![]() ρ(浓硫酸),若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数为
ρ(浓硫酸),若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数为![]() =
= ,
, ![]() 1,则所得溶液中溶质质量分数
1,则所得溶液中溶质质量分数![]() 49%。
49%。
(3)定容时,若加入的水超过刻度线,必须采取的措施是重新配制。
(4)根据公式cB=![]() 分析。
分析。
①转移溶液后,未洗涤烧杯,溶质物质的量偏小,所配溶液浓度偏低。
②容量瓶用水洗净后未烘干,溶质物质的量和溶液体积都不变,对所配溶液浓度无影响。
③定容时俯视容量瓶的刻度线,溶液体积偏小,所配溶液浓度偏高。
(5)A项,使用容量瓶前检查它是否漏水,正确;B项,容量瓶用蒸馏水洗净后,若用待配液润洗,则使所配溶液浓度偏高,错误;C项,用量筒准确量取的 18.4mol·L-1 的硫酸,不能直接注入容量瓶中,应先在烧杯中稀释并冷却至室温后再转移入容量瓶中,错误;D项,将硫酸溶于水后需冷却至室温再转移到容量瓶中,正确;E项,定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀,不是用手掌托住瓶底,错误;答案选BCE。


科目:高中化学 来源: 题型:
【题目】SO2 既有氧化性又有还原性,还有漂白性。下列对它变化中表现的性质标注正确的是( )
①SO2使溴水褪色(氧化性)
②SO2使品红溶液褪色(漂白性)
③SO2通入氢硫酸(H2S)产生淡黄色浑浊(还原性)
④SO2使润湿的蓝色石蕊试纸变红(水溶液酸性)
A. 只有②④ B. 只有③④ C. 只有①③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式中,错误的是( )
A.将氨通入盐酸中:NH3+H+===NH4+
B.在NaOH溶液中滴入NH4Cl溶液:NH4++OH-===NH3.H2O
C.将少量铜屑放入浓硝酸中:Cu+4H++2NO3-===Cu2++2NO2 ↑ +2H2O
D.将稀硫酸滴在铜片上:Cu+2H+===Cu2++H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与常用危险化学品的类别不对应的是
A. Na、K——遇湿易燃物品 B. TNT、NH4NO3——爆炸品
C. CH4、C2H5OH——易燃气体 D. 浓H2SO4、浓HNO3——腐蚀品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y两种原子,X原子的M电子层比Y原子的M电子层少3个电子,Y原子的L电子层的电子数恰好为X原子L电子层电子数的2倍,X和Y分别是
A.碳和铝B.硅和钠C.硼和氮D.氯和碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。
(1)下列有关叙述正确的是_____(填写序号)
a.使用托盘天平的第一步操作是将游码移至标尺零刻度处
b.过滤操作过程中,为加快过滤速度可用玻璃棒对漏斗中的溶液进行搅拌
c.用浓硫酸配制稀溶液时,在量简中稀释后要冷却至室温再转移到容量瓶中
d.用容最瓶配制溶液时,定容后摇匀液面下降,再加蒸馏水至刻度线处,所得溶液浓度偏低
(2)现有六种气体:H2、O2、NH3、SO2、NO2、NO。可以利用如图所示裝置进行收集。

① 若气体从B口进入,可收集的气体是:___________;
② 若在烧瓶中注满水,则气体应该从______(填写“A”或“B”)口进入,可以收集的气体是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)![]() Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
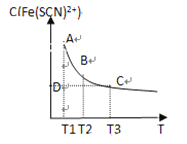
A. FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为Fe3+(aq)+SCN—(aq)![]() Fe(SCN)2+(aq) ΔH >0
Fe(SCN)2+(aq) ΔH >0
B. 温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2
C. 反应处于D点时,一定有υ正>υ逆
D. A点与B点相比,A点的c(Fe3+)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验的说法中正确的是( )
A. 除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤
B. 不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液
C. 制备Fe(OH)3胶体时,通常是将Fe(OH)3固体溶于沸水中
D. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属钠及其化合物广泛应用于医药、工农业生产和化工领域。回答下列问题:
(1)碱金属的焰色反应及霓虹灯光、激光等现象与原子核外电子发生_________有关。电子排布式为1s22s22p63s23p54s2是_________(填元素符号)原子的_________态原子。
(2)钠形成的化合物均为离子化合物,原因是___________________________。
(3)钠的有机盐是一类重要的钠盐,如丙酸钠(CH3CH2COONa)和氨基乙酸钠(H2NCH2COONa)。
①CH3CH2COO中均为共价键,共价键类型有σ键和π键,σ键与π键的个数比为_________;H2NCH2COO中N原子的杂化轨道类型为_________,C原子的杂化轨道类型为_________。
②丙酸钠和氨基乙酸钠均能水解,水解产物有丙酸和氨基乙酸,二者部分数据如下表:
熔点/℃ | 沸点/℃ | 水溶解性 | |
丙酸 | 21.5 | 141.1 | 能与水混溶 |
氨基乙酸 | 186 | 234 | 易溶于水 |
由熔点数据可知,常温下丙酸为液体,而氨基乙酸为固体,主要原因是__________________,二者均易溶解于水,而相对分子质量与其相差不大的戊烷却难溶于水,原因是__________________。
(4)Na2O晶胞结构如图所示,其中钠为_________(选填“甲”或“乙”),其晶胞参数a=0.566 nm,则Na2O的密度为_________________g·cm3。(列式即可,不必计算出结果,NA =6.02×1023 mol1)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com