
【题目】下列方程式中,错误的是( )
A.将氨通入盐酸中:NH3+H+===NH4+
B.在NaOH溶液中滴入NH4Cl溶液:NH4++OH-===NH3.H2O
C.将少量铜屑放入浓硝酸中:Cu+4H++2NO3-===Cu2++2NO2 ↑ +2H2O
D.将稀硫酸滴在铜片上:Cu+2H+===Cu2++H2 ↑
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。下列有关分析正确的是
A.K3C60中只有离子键B.K3C60中碳元素显-3价
C.该晶体在熔融状态下能导电D.C60与12C互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·3H2O2)是由Na2CO3与H2O2复合而形成的一种固体放氧剂,同时具有Na2CO3和H2O2双重性质。可用于洗涤、纺织、医药、卫生等领域。工业上常以过碳酸钠产品中活性氧含量([O]%=![]() ×100%)来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如图:
×100%)来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如图:
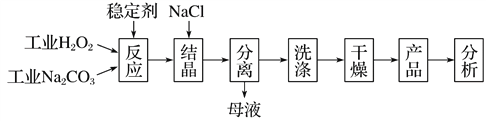
回答下列问题:
(1)过碳酸钠受热易分解,写出反应的化学方程式:_____________。
(2)稳定剂及反应温度等因素对产品质量有很大影响。
①下列试剂中,可能用作“稳定剂”的是________(填字母)。
a.MnO2 b.KI
c.Na2SiO3 d.FeCl3
②反应温度对产品产率(y%)及活性氧含量的影响如下图所示。要使产品达到优等品且产率超过90%,合适的反应温度范围是______________。
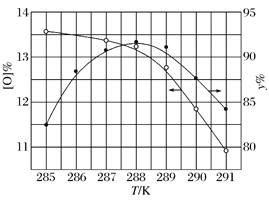
③“结晶”时加入NaCl的目的是______________。
(3)“母液”中可循环利用的主要物质是______________。
(4)产品中活性氧含量的测定方法:称量0.160 0 g样品,在250 mL锥形瓶中用100 mL 0.5 mol·L-1硫酸溶解完全,立即用0.020 00 mol·L-1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56 mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24 mL。
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有_____________。
②该样品的活性氧含量为________% 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的溶液中能大量共存的一组离子或分子是
A. Na+、Mg2+、ClO—、NO3— B. Al3+、 NH4+、 Br-、Cl-
C. K+、Cr2O72-、CH3CHO、 SO42- D. Na+、K+、SiO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是我校实验室化学试剂浓硫酸标签上的部分内容。现需要 240 mL 1 mol· L-1 的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用 的仪器有:① 胶头滴管;②玻璃棒;③烧 杯;④量筒。 请回答下列问题:

(1)配制稀硫酸时,还缺少的仪器有________(写仪器名称)。
(2)该硫酸的物质的量浓度为__________ mol/L;所需浓硫酸的体积约为_______mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(3)定容时,若加入的水超过刻度线,必须采取的措施是__________
(4)下列操作对 H2SO4 的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:__________ ;
②容量瓶用水洗净后未烘干:__________ ;
③定容时俯视容量瓶的刻度线:__________ 。
(5)在配制过程中,下列操作不正确的是(填序号) __________ 。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将准确量取的 18.4mol·L-1 的硫酸,注入已盛有100mL水的500mL的容量瓶中,加水至刻度线.
D.将硫酸溶于水后需冷却至室温再转移到容量瓶中
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手掌托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是 ( )
A. Cu、Fe3+ B. Fe2+、Fe3+ C. Cu、Cu2+、Fe D. Cu、Fe2+、Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com