
【题目】以碳纳米管为电极、利用电化学储氢的装置模型如下:

下列说法中正确的是
A. Y是电源的正极,储氢时碳纳米管B上发生氧化反应
B. 生成储氢物质的电极反应式为C6H6+6e -+6H+=C6H12
C. 当电路中通过1 mol电子时,碳纳米管A上产生5.6LO2
D. 储氢过程中碳纳米管B上不可能有氢气产生
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程图. 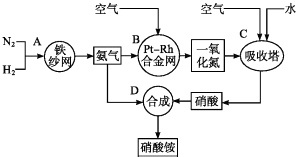
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式: .
(2)B装置中Pt﹣Rh合金网的作用是
(3)写出B中的反应方程式: .
(4)写出D中的反应方程式: .
(5)吸收塔C中通入空气的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
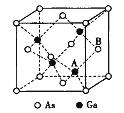
【题目】砷化稼(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]_______________。
(2)根据元素周期律,元素的电负性Ga______(填“大于”或“小于”, 下同)As,第一电离能B ____ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______。
(3)杀虫剂Na3AsO4中阴离子的空问构型为______,As原子采取________杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是____________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价健数为______;A原子距离B原子所在六面体的侧面的最短距离为______ (用x表示)pm ;该晶胞的密度为_____g·cm-3。(阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:

(1)铝热法冶炼金属铬,是利用了金属铝的____(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、_______。
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4 mol CrO42-,消耗氧化剂(O2)的物质的量是____。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______。
②滤渣B受热分解所得物质可以循环利用,B是_______。
③已知:2 CrO42-+ 2H+ ![]() Cr2O72-+ H2O K = 4.0×1014
Cr2O72-+ H2O K = 4.0×1014
滤液3中Cr2O72-的浓度是0.04 mol/L,则CrO42-的浓度是_______ mol/L。
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0°C | 20°C | 40°C | 60°C | 80°C |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 12.3 | 26.3 | 45.6 | 73.0 | |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程Ⅱ得到K2Cr2O7粗品的操作是:向滤液③中加入稀盐酸和KCl固体,然后_______________、过滤得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃在一定条件下既可发生水解反应,又可发生消去反应,现以 2-溴丙烷为主要原料 制取 1,2-丙二醇时,需要经过的反应是( )
A.消去—加成—取代
B.加成—消去—取代
C.取代—消去—加成
D.取代—加成—消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分Al2O3,含SiO2、Fe2O3等杂质)冶炼铝的主要流程如下:

(注:SiO2碱溶时转变为铝硅酸钠沉淀)
下列叙述错误的是
A. 操作I增大NaOH溶液用量可提高Al2O3的浸取率
B. 操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧
C. 通入过量CO2的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 加入的冰晶石目的是降低Al2O3的熔融温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)烟气脱硫、脱硝的环境意义是;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 ![]() 7N2+12H2O
7N2+12H2O
①上述反应中被还原的元素是(填元素符号),反应中每转移2.4mol电子,生成N2的物质的量为 .
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3 ![]() O+O2
O+O2
Ⅱ、NO+O3→NO2+O2
Ⅲ、NO2+O→NO+O2
上述反应中NO所起的作用是 .
(3)表列出了2种燃煤烟气脱硫方法的原理.
方法Ⅰ | 用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3 , 写出该反应的离子方程式: , 是利用了SO2的性质(选填字母编号).
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com