
【题目】如图所示是工业生产硝酸铵的流程图. 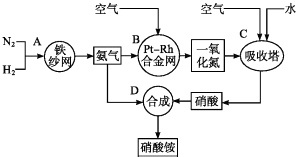
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式: .
(2)B装置中Pt﹣Rh合金网的作用是
(3)写出B中的反应方程式: .
(4)写出D中的反应方程式: .
(5)吸收塔C中通入空气的目的是 .
【答案】
(1)N2+3H2 ![]() 2NH3
2NH3
(2)催化剂
(3)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(4)NH3+HNO3=NH4NO3
(5)利用空气中的氧气将NO氧化
【解析】解:从流程图可知,N2和H2在红热铁砂网的催化作用下合成氨气,氨气和空气中的O2在铂铑合金网的催化作用下发生催化氧化生成NO和H2O,将NO和空气、水混合,NO和O2和水反应生成HNO3 , 然后NH3和HNO3反应生成NH4NO3 . (1)N2和H2在红热铁砂网的催化作用下合成氨气,化学方程式为:N2+3H2 ![]() 2NH3 , 所以答案是:N2+3H2
2NH3 , 所以答案是:N2+3H2 ![]() 2NH3;(2)B装置中在的催化作用下,氨气和氧气发生催化氧化反应,所以答案是:催化剂;(3)B装置中在Pt﹣Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2
2NH3;(2)B装置中在的催化作用下,氨气和氧气发生催化氧化反应,所以答案是:催化剂;(3)B装置中在Pt﹣Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2 ![]() 4NO+6H2O,所以答案是:4NH3+5O2
4NO+6H2O,所以答案是:4NH3+5O2 ![]() 4NO+6H2O;(4)在D中,NH3和HNO3反应生成NH4NO3 , 故化学方程式为:NH3+HNO3=NH4NO3 , 所以答案是:NH3+HNO3=NH4NO3;(5)在C中,将NO和空气、水混合后,NO和O2和水反应生成HNO3 , 其中氧气做氧化剂,所以答案是:利用空气中的氧气将NO氧化.
4NO+6H2O;(4)在D中,NH3和HNO3反应生成NH4NO3 , 故化学方程式为:NH3+HNO3=NH4NO3 , 所以答案是:NH3+HNO3=NH4NO3;(5)在C中,将NO和空气、水混合后,NO和O2和水反应生成HNO3 , 其中氧气做氧化剂,所以答案是:利用空气中的氧气将NO氧化.


科目:高中化学 来源: 题型:
【题目】某直链氨基酸的1个分子只有1个氮原子,此酸0.159克溶于水后用0.107mol/LKOH的溶液滴定,用去20.25mL才完全中和,若取2.94g此氨基酸用酸处理,然后将其与碱共热使其中全部的氮转化为NH3(设其体积为标况下)448mL.
(1)求该氨基酸的相对分子质量;__________
(2)推断化学式;__________
(3)写出其结构简式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应: 2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法正确的是( )
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法正确的是( )
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应平均速率为0.3 mol·L-1·s-1
③2 s时物质A的转化率为70%④2 s时物质B的浓度为0.7 mol·L-1
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的物质,一定互为同系物的是
A.C2H4 和C4H8B.CH4和C3H8C.C2H6O和C3H8OD.C2H4Br2和C3H6Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下;

相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是______________________。
(2)反应①和②分别在装置_________________和 __________________中进行(填装置符号)。
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是____________,优点是用量少,缺点是_____________。
(4)反应②为________________(填“放热”或“吸热”)反应。反应温度控制在50~60℃,温度过高的安全隐患是_______________________。
(5)中和釜D中加入的Z最适宜的是________________________(填编号。已知苯酚是一种弱酸)。
A.NaOH B.CaCO3 C.NaHCO3 D.CaO
(6)蒸馏塔F中的馏出物T和P分别为___________和_____________,判断的依据是__________________。
(7)用该方法合成苯酚和丙酮的优点是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol Fe3O4与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为
A. 62(a+b) g B. 186(a+b) g
C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50mol·L﹣1盐酸与50mL 0.55mol·L﹣1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________.
(2)烧杯间填满碎纸条的作用是__________________________.
(3)大烧杯上如不盖硬纸板,求得的中和热数值_______(填“偏大”“偏小”“无影响”).
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________.(填“偏大”“偏小”“无影响”)
(5)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______________________________________________________.若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_________kJ·mol﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以碳纳米管为电极、利用电化学储氢的装置模型如下:

下列说法中正确的是
A. Y是电源的正极,储氢时碳纳米管B上发生氧化反应
B. 生成储氢物质的电极反应式为C6H6+6e -+6H+=C6H12
C. 当电路中通过1 mol电子时,碳纳米管A上产生5.6LO2
D. 储氢过程中碳纳米管B上不可能有氢气产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com