
【题目】50mL 0.50mol·L﹣1盐酸与50mL 0.55mol·L﹣1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________.
(2)烧杯间填满碎纸条的作用是__________________________.
(3)大烧杯上如不盖硬纸板,求得的中和热数值_______(填“偏大”“偏小”“无影响”).
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________.(填“偏大”“偏小”“无影响”)
(5)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______________________________________________________.若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_________kJ·mol﹣1.
【答案】 环形玻璃搅拌棒 减少热量的散失 偏小 偏小 2H2(g)+O2(g ) =2H2O(g) △H=-483.6 kJ·mol-1 285.8
【解析】试题分析:(1)根据测定中和热实验装置回答;(2)根据避免热量散失回答;(3)如不盖硬纸板,产生的热量散失较多;(4)氨水是弱电解质,电离吸热,用相同浓度和体积的氨水代替NaOH溶液,放出热量少;(4)放热反应焓变<0;根据盖斯定律计算氢气的燃烧热。
解析:(1)测定中和热需要用环形玻璃搅拌棒搅拌,所以缺少的玻璃仪器是环形玻璃搅拌棒;(2)碎纸条可以隔热,烧杯间填满碎纸条的作用是减少热量的散失;(3)大烧杯上如不盖硬纸板,产生的热量散失较多,求得的中和热数值偏小;(4)氨水是弱电解质,电离吸热,用相同浓度和体积的氨水代替NaOH溶液,放出热量少,测得的中和热的数值会偏小;(5)由氢气和氧气反应生成2mol水蒸气放热483.6 kJ,放热反应焓变为负值,反应的热化学方程式:2H2(g)+O2(g ) =2H2O(g) △H=-483.6 kJ·mol-1;1g水蒸气转化成液态水放热2.444kJ,则1mol水蒸气转化成液态水放热44kJ,根据盖斯定律,氢气和氧气反应生成1mol液态水放热285.8kJ,即氢气的燃烧热是285.8 kJ·mol﹣1。


科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( )
A.Na+、SO42﹣、Cu2+、Cl﹣
B.Fe2+、Na+、OH﹣、K+
C.K+、CO32﹣、Cl﹣、Ag+
D.H+、Cl﹣、Na+、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2+O2═2H2O,正极反应为:O2+2H2O+4e﹣═4OH﹣ , 下列叙述不正确的是( )
A.H2通入负极区
B.O2通入正极区
C.负极反应为2H2+4OH﹣﹣4e﹣═4H2O
D.正极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是工业生产硝酸铵的流程图. 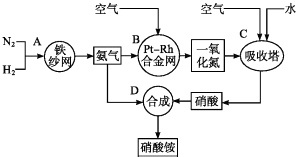
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式: .
(2)B装置中Pt﹣Rh合金网的作用是
(3)写出B中的反应方程式: .
(4)写出D中的反应方程式: .
(5)吸收塔C中通入空气的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化稼(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]_______________。
(2)根据元素周期律,元素的电负性Ga______(填“大于”或“小于”, 下同)As,第一电离能B ____ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______。
(3)杀虫剂Na3AsO4中阴离子的空问构型为______,As原子采取________杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是____________。
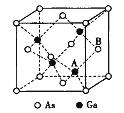
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价健数为______;A原子距离B原子所在六面体的侧面的最短距离为______ (用x表示)pm ;该晶胞的密度为_____g·cm-3。(阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:

(1)铝热法冶炼金属铬,是利用了金属铝的____(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、_______。
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4 mol CrO42-,消耗氧化剂(O2)的物质的量是____。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______。
②滤渣B受热分解所得物质可以循环利用,B是_______。
③已知:2 CrO42-+ 2H+ ![]() Cr2O72-+ H2O K = 4.0×1014
Cr2O72-+ H2O K = 4.0×1014
滤液3中Cr2O72-的浓度是0.04 mol/L,则CrO42-的浓度是_______ mol/L。
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0°C | 20°C | 40°C | 60°C | 80°C |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 12.3 | 26.3 | 45.6 | 73.0 | |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程Ⅱ得到K2Cr2O7粗品的操作是:向滤液③中加入稀盐酸和KCl固体,然后_______________、过滤得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分Al2O3,含SiO2、Fe2O3等杂质)冶炼铝的主要流程如下:

(注:SiO2碱溶时转变为铝硅酸钠沉淀)
下列叙述错误的是
A. 操作I增大NaOH溶液用量可提高Al2O3的浸取率
B. 操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧
C. 通入过量CO2的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 加入的冰晶石目的是降低Al2O3的熔融温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com