
【题目】黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义。
(1)工业上煅烧黄铁矿可制取SO2。已知下列热化学方程式
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol
S(s)+O2(g)=SO2(g) △H=bkJ/mol
Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol
则4Fe(s)+3O2(g)=2Fe2O3(s) △H=_____kJ/mol
(2)一种酸性条件下催化氧化黄铁矿的物质转化关系如图I所示。
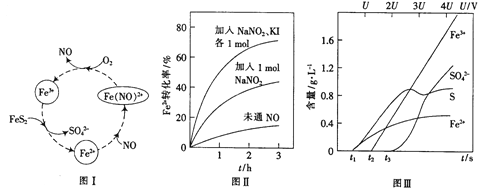
(1)写出如图中Fe3+与FeS2反应的离子方程式:______________。
(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是______________。
(3)控制Fe2+的浓度、溶液体积和通入O2的速率一定,图II所示为改变其他条件时Fe2+被氧化的转化率随时间的变化。
① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。若1mol NaNO2完全反应则转移电子的数目为______mol。
② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。解释图II中该条件下能进一步提高单位时间内Fe2+转化率的原因:______________。
(4)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生粒子的含量与时间、电压(U)的关系如图III所示。
①写出t1至t2间FeS2所发生的电极反应式:__________。
②当电压的值介于3U~4U之间,FeS2放电所得主要粒子为___________。
【答案】 a+4c-8b 14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+ 稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,NO2不能 2/3 生成的催化剂NO更多,加快了反应速率 FeS2-2e-=Fe2++2S Fe3+、SO42-
【解析】(1)①4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H=akJ/mol,②S(s)+O2(g)=SO2(g) △H=bkJ/mol,③Fe(s)+2S(s)=FeS2(s) △H=ckJ/mol,将①×1-②×8+③×4,则4Fe(s)+3O2(g)=2Fe2O3(s) △H=(a+4c-8b)kJ/mol;(2)硝酸也可将FeS2氧化为Fe3+和SO42-,使用浓硝酸比使用稀硝酸反应速率慢,其原因是稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,NO2不能。(3)① 加入NaNO2发生反应:2H++3NO2-=NO3-+2NO+H2O。每3molNO2―反应,有1moLNO2―作氧化剂,则有2mol作还原剂,若1mol NaNO2完全反应则转移电子的数目为2/3mol。② 加入NaNO2、KI发生反应:4H++2NO2-+2I-=2NO+I2+2H2O。该条件下能进一步提高单位时间内Fe2+转化率的原因:生成的催化剂NO更多,加快了反应速率;(4)由图① t1至t2间Fe2+和2S的是增加,FeS2所发生的电极反应式:FeS2-2e-=Fe2++2S ,②当电压的值介于3U~4U之间,Fe3+、SO42-浓度增加,FeS2放电所得主要粒子为Fe3+、SO42-。


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】以重要的化工原料A(C2H2)合成有机物E和 的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。

回答下列问题:
(1)B的系统命名是______________;已知C是顺式产物 ,则C的结构简式为_____________________________。
(2)写出⑤的化学方程式:________________________________,反应类型是________________。、
(3)反应⑧产物与新制Cu(OH)2的化学方程式:______________________________。
(4)符合下列条件肉桂酸( )的同分异构体有多种,①分子中含有苯环和碳碳双键,②能够发生银镜反应,③遇FeCl3溶液显紫色,写出其中核磁共振氢谱图中有六组峰,且峰面积之比为1∶1∶1∶1∶2∶2的结构简式_________________。
)的同分异构体有多种,①分子中含有苯环和碳碳双键,②能够发生银镜反应,③遇FeCl3溶液显紫色,写出其中核磁共振氢谱图中有六组峰,且峰面积之比为1∶1∶1∶1∶2∶2的结构简式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制1mol/L NaOH溶液240ml,请回答:
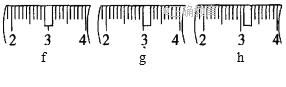
(1)需称取NaOH固体____________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小___________(填字母),并在下图中选出能正确表示游码位置的选项____________(填字母)。
附表砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有_____________________________。
(3)下列操作的顺序是(用序号表示)_________________。
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________
②将热的溶液直接移入了容量瓶________________
③定容时,仰视容量瓶的刻度线________________
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的KClO3中加入浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,其中氧化产物和还原产物的质量之比为
A. 1:6 B. 6:1 C. 5:1 D. 1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《唐本草》记载:……本来绿色,新出窟未见风者,正如璃璃。陶及今人谓之石胆,烧之赤色,故名绛矾矣”。文中“绛矾”为
A. FeSO4·7H2O B. CuSO4·5H2O
C. Na2SO4·10H2O D. KAl(SO4)2·12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中c(Cl-)与100 mL lmol/LAlCl3溶液中c(Cl-)相等的是
A. 300mLlmol/L的NaCl溶液 B. 150mL2mol/L酌NH4Cl溶液
C. 200mL l.5 mol/L的KCl溶液 D. 75mLlmol/L的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,草酸晶体(H2C2O4·2H2O)无色,溶点为101 ℃,易溶于水,受热脱水、升华,170 ℃以上分解,回答下列问题:
(1)按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到有气泡逸出,澄清石灰水变浑浊的现象,由此可知草酸晶体分解的产物中有________,装置B的主要作用是_________________________________________________________________。

(2)同学认为草酸晶体分解的产物中含有CO,为进行验证,选用下图所示的部分装置(可以重复选用)进行实验。依次连续的合理顺序为A、B、____________、I(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不互为同分异构体的是( )
A. 2,2—二甲基丙醇和2—甲基丁醇 B. 邻氯甲苯和对氯甲苯
C. 2—甲基丁烷和戊烷 D. 甲基丙烯酸和甲酸丙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com