
| A、在室内放置一些特别的绿色植物,可用于室内空气的净化 |
| B、合金的熔点一般高于各组成成分金属的熔点 |
| C、氢氧化钠溶液用盖橡胶塞的试剂瓶盛装 |
| D、工业上用盐酸刻蚀玻璃 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和此溶液所需的0.1 mol?L-1 NaOH溶液的体积增加 |
| B、c(CH3COOH)减小,平衡向电离方向移动,c(CH3COO-)增大 |
| C、平衡向电离方向移动,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均减小 |
| D、电离程度增大,由CH3COOH电离出的n(H+)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
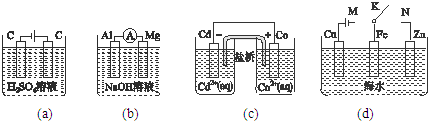
| A、图(a)中,随着电解的进行,溶液中H+的浓度越来越小 |
| B、图(b)中,Mg电极作电池的负极 |
| C、图(c)中,发生的反应为Co+Cd2+=Cd+Co2+ |
| D、图(d)中,K分别与M、N连接时,Fe电极均受到保护 |
查看答案和解析>>
科目:高中化学 来源: 题型:
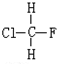 与
与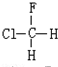
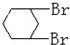 与
与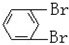
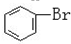 与
与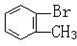
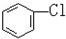 与
与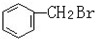
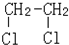 与CH3-CH2Cl.
与CH3-CH2Cl.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(gO2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是一种共价化合物 |
| B、可由PH3与HI化合生成 |
| C、在加热的条件下,可以分解产生有色气体 |
| D、能跟碱反应放出PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
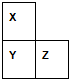 X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.
X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
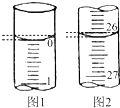 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com