
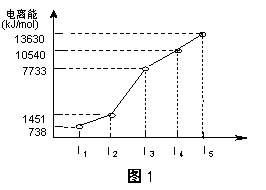
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:
(1)X原子的电子排布式为___________。
(2)电负性:X ______Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的
化工原料。有关Z2H4分子的说法正确的是______(填字母)。
A.Z的原子与氢原子形成的化学键可以旋转 B.不含非极性键
C.分子中含有氢键 D.含有4个σ键和1个π键
(4)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是_____ (填字母)。
A.离子键 B.极性键 C.配位键 D.金属键
 |
科目:高中化学 来源: 题型:
工业制硫酸生产流程如下图:
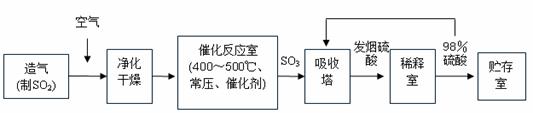
已知:在450℃,常压下,2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为
A.净化气体  B.控制温度在400~500℃
B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变 为97.2L,则SO2的转化率为
为97.2L,则SO2的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质与氢键无关的是( )
A.冰的密度比液态水的密度小 B.NH3易液化
C.NH3 分子比PH3 分子稳定 D.在相同条件下,H2O的沸点比H2S的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
A.X:3s23p2 Y:3s23p5 B.X:2s22p3 Y:1s1
C.X:3s2 Y:2s22p5 D.X:2s22p3 Y:2s22p4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A. X与Y组成化合物时,X显负价,Y显正价
B. 第一电离能Y一定小于X
C. 最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D. 气态氢化物的稳定性:HmY小于HmX
查看答案和解析>>
科目:高中化学 来源: 题型:
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。
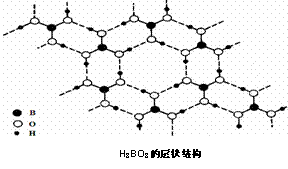 下列有关说法正确的是( )
下列有关说法正确的是( )
A.正硼酸晶体中只存在氢键
B.H3BO3分子的稳定性与氢键无关
C.分子中硼原子最外层为8e— 稳定结构
D.含1molH3BO3的晶体中有6mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子反应方程式为( )
A.惰性电极电解MgCl2溶液:2Cl- +2 H2O 2OH- +Cl2↑ +H2↑
2OH- +Cl2↑ +H2↑
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.HS-的电离: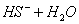
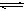
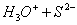
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2 、 NO2 、 O2 乙:MgO 、 NO2 、 O2
丙:Mg3N2 、 O2 丁:MgO 、 NO2 、 N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
|
|
|
|
|
|
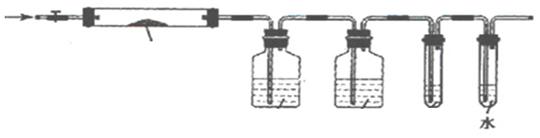
A B C D E
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3 . 79 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 ,然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是 。(用化学方程式表示)
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com