
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2 、 NO2 、 O2 乙:MgO 、 NO2 、 O2
丙:Mg3N2 、 O2 丁:MgO 、 NO2 、 N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
|
|
|
|
|
|
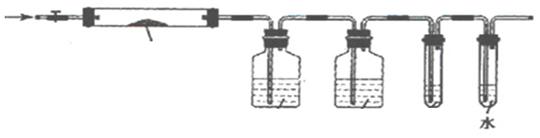
A B C D E
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3 . 79 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 ,然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是 。(用化学方程式表示)
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
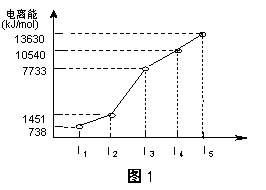
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:
(1)X原子的电子排布式为___________。
(2)电负性:X ______Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的
化工原料。有关Z2H4分子的说法正确的是______(填字母)。
A.Z的原子与氢原子形成的化学键可以旋转 B.不含非极性键
C.分子中含有氢键 D.含有4个σ键和1个π键
(4)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是_____ (填字母)。
A.离子键 B.极性键 C.配位键 D.金属键
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是 ( )
A.950mL,111.2g B.500mL,117g C.1000mL,117g D.1000mL,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
| 编号 | 化学反应 | 离子方程式 | 评 价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH =CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| B | 苯酚钠溶液中通入CO2 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- | 正确 |
| C | NaHCO3的水解 | HCO3-+H2O═CO32-+H3O+ | 错误,水解方程式误写成电离方程式 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是
A.Zn和浓H2SO4 B Na2O2和NH4Cl浓溶液C.Cu和浓HNO3 D.C和浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
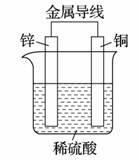
如图是锌、铜和稀硫酸形成的原电池,下列叙述不合理的是
A.溶液中H+向Zn电极移动
B.外电路中电流方向为:Cu→Zn
C.负极上的电极反应:Zn-2e-===Zn2+
D.有1 mol电子流过导线,则Cu电极上产生的H2为11.2 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应X(g)+3Y(g) 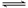 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应: 负极:Pb+SO42-= PbSO4+2e- 正极:PbO2+4H++SO42-+2e- = PbSO4+2H2O
今若制得Cl2 0.10 mol,这时电池内消耗的H2SO4的物质的量至少是
A.0.025 mol B. 0.050 mol
C.0.10 mol D.0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列递变规律不正确的是( )
A.Na、Mg、Al还原性依次减弱 B. C、N、O原子半径依次增大
C.I2、Br2、Cl2氧化性依次增强 D.P、S、Cl最高正价依次升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com