
����Ŀ������������Ũ�����ܽ�ľ̿��������CO2 �� ��������ԭ��SO2��������ͼ���и�װ�����һ��ʵ�飬����֤������Ӧ�������ĸ��ֲ��
��1����Щװ�õ�����˳���ǣ������������������ҵķ�����дװ�õı�ţ�����������
��2��ʵ��ʱ�ɹ۲쵽װ�â���Aƿ����Һ��ɫ��Aƿ��Һ�������� �� Bƿ��Һ�������� �� Cƿ��Һ����������д��B�з��������ӷ���ʽ��
��3��װ�â������ӵĹ���ҩƷ�� �� ����֤�IJ�������
��4��װ�â�����ʢ��Һ�� �� ����֤�IJ�������
���𰸡�
��1���ܣ��ڣ��٣���
��2�������������ȥ������������������Ƿ���ڣ���ֹ���Ŷ�����̼���飻5SO2+ 2MnO4-+2H2O= 5SO42- +2Mn2++4H+
��3����ˮ����ͭ��ˮ
��4������ʯ��ˮ��CO2
����������1��������̼�Ͷ���������ʹ����ʯ��ˮ����ǣ������������ܱ����Ը��������Һ������ʹ���Ը��������Һ��ɫ����ʹƷ����Һ��ɫ������Ư���ԣ���������̼û�д����ʣ����Լ��������̼֮ǰ�ȼ����������ˮ��������ˮ����ͭ���飬��������˳���ǣ������Ʊ���ˮ�����������������������ȥ���������������������������̼���飬����������˳���Ǣܡ��ڡ��١��ۣ�
��2��ʵ��ʱ�ɹ۲쵽װ�â���Aƿ����Һ��ɫcƿ����Һ����ɫ��˵��ͨ��cƿ�������в�����������A�������Ǽ��������������Ʒ����Һ��ɫ�������������������л�ԭ�ԡ����Ը�����ؾ���ǿ�����ԣ����߷���������ԭ��Ӧ��ʹ���Ը��������Һ��ɫ������B�������dz�ȥ��������C�������Ǽ�����������Ƿ���ڣ���ֹ���Ŷ�����̼���飻B��SO2ʹ���Ը��������Һ��ɫ��������Ӧ�����ӷ���ʽΪ5SO2+ 2MnO4-+2H2O= 5SO42- +2Mn2++4H+��
��3��ˮ������ʹ��ˮ����ͭ����ɫ��Ϊ��ɫ����������ˮ����ͭ����ˮ����������װ�â�����װ�Ĺ���ҩƷ����ˮ����ͭ������֤�IJ�����ˮ��
��4��������̼��ʹ����ʯ��ˮ����ǣ�����ʵ�����ó���ʯ��ˮ���������̼����װ�â�����ʢ��Һ�dz���ʯ��ˮ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ��ȫ����˵���顷�жԵ�ʯ������Ϊ������ˮ��ʪ����Ѹ�ٲ����߶���ȼ����Ȳ���壬Ӧ�������������ʷֿ���š���������˵�����������ǣ� �� 
A.ʢװ��ʯ�İ�װ�����е�Σ�ջ�ѧƷ��־Ϊ��
B.��ʯ������ֿ����
C.�����ʯ����Ͱ�ڿɳ��뵪��
D.��ʯ�Ż������ĭ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ���仯����һ��������Ͷ���������Ⱦ����þԭ��طŵ�ʱ��ѹ�߶�ƽ�ȣ�Խ��Խ��Ϊ����������ɫԭ��صĹ�ע���㣮����һ��þԭ��صķ�ӦΪ��xMg+Mo3S4 ![]() MgMo3S4 �� ����˵����ȷ���ǣ� ��
MgMo3S4 �� ����˵����ȷ���ǣ� ��
A.��طŵ�ʱ��Mg2+��Ǩ��
B.��طŵ�ʱ��������ӦΪMo3S4+2xe��+xMg2+�TMgxMo3S4
C.��س��ʱ������������ԭ��Ӧ����Mo3S4
D.��س��ʱ��������ӦΪxMg��2xe���TxMg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ�����ĩ�����ܺ���K2SO4��Na2CO3��NH4Cl��BaCl2��CuSO4�е�һ�ֻ��֣������²������ʵ�飺
��ȡ���������ĩ�ӵ�����ˮ�У��õ���ɫ��Һ��
��ȡ������Һ�������������м�������ϡ���ᣬ�����ݲ�����
�ۼ�������е���Һ�μ�Ba��NO3��2��Һ���а�ɫ�������ɣ�
��ȡ������Һ����������NaOH��Һ�����ȣ������̼�����ζ�����壬����ʪ��ĺ�ɫʯ����ֽ�������壬��ֽ������
����������ʵ�жϣ�
��1���϶����ڵ�����
��2���϶������ڵ�����
��3������ȷ���Ƿ���ڵ��� �� �����֤���������Ƿ���ڵ�ʵ�鷽����ʵ�鷽���������ۣ� ��
��4��д������ʵ����в����̼�����ζ���巴Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС������ͼװ�ý���ʵ�飬����˵����ȷ���ǣ� �� 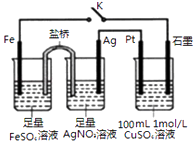
A.�����еĵ���ʿ�����KC1
B.�պ�K��ʯī�缫��ֻ����ͭ
C.����0.1mol Fe�ܽ�ʱ���������Һ�ĵ��Ӹ���Ϊ1.204��1023
D.����������0.3mol����ʱ������11.1gCu2��OH��2CO3 �� CuSO4��Һ�ɻָ�ԭ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�к�����Ϊ���뷴Ӧ������ʵ�����������Ϊ�������������ʵ��������з�Ӧ��Ӧ�����ߴ�����ǣ� �� 
A.��NaAlO2��Һ�е���HCl������
B.�����ʯ��ˮ��ͨ��CO2������
C.���������AlCl3��Һ�е���NaOH��Һ������
D.���е����ʵ�����Ca��OH��2��KOH�Ļ����Һ��ͨ��CO2��������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����������������·�Ӧ��ϵ��KBrO3�ܽ�KI������I2�� Br2�ܽ�I������ΪI2 �� IO3��Ҳ�ܽ�Br������ΪBr2 �� �䱾������ԭΪI2 �� ������1mol KI��������Һ�м��뺬amol KBrO3��Һ��a��ȡֵ��ͬ�����ò���Ҳ��ͬ�������ж���ȷ�ǣ� ��
��� | a��ȡֵ��Χ | ����Ļ�ѧʽ�������ӷ��ţ� |
�� | a�� | I2Br�� |
�� |
| I2Br��Br2 |
�� |
| I2 IO3�� Br2 |
�� | a�� | IO3�� Br2 |
A.�٢ۢ�
B.�ڢۢ�
C.�٢ڢۢ�
D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���´��������������´�����������ȩ:HCHO+O2��CO2+H2O���÷�Ӧ
A. ��Ӧ����������ж�ֻ�����Է���
B. ��Ӧ����������Ϊ���Ӿ���
C. ��Ӧʱ�м��Լ��ͷǼ��Լ��Ķ��Ѻ����ǵ�����
D. ������CO2�ļ��ܴ���H2O�����Էе����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������˳�ʱ���������Ի���Ե�ʳ�����Ϊ
A.�������ʷdz����ã�����ʱ��������ѧ��Ӧ
B.�������ԣ��ȿ����ᷴӦ��������Ӧ
C.��������������������ԣ����ᡢ��ܷ�Ӧ���ƻ�������
D.���ж����ܽ������ʳ���������Σ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com