
W、X、Y、Z、R属于短周期元素。已知它们都不是稀有气体元素,W的原子半径是所属周期中最大,X元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,Z元素与Y元素同主族,R元素原子与X元素原子的核外电子数之比为2∶1。下列叙述中,错误的是
| A.分别由Y、Z组成的单质一定都为原子晶体 |
| B.W与X形成的两种化合物中阴、阳离子的个数比均为1∶2 |
| C.Y、Z、R最高价氧化物对应水化物的酸性强弱顺序:R>Z>Y |
| D.X的氢化物比R的氢化物稳定,X的氢化物熔沸点比R的氢化物低 |
AD
解析试题分析:W、X、Y、Z、R均为短周期元素,它们都不是稀有气体元素,在短周期元素原子中,W元素原子半径最大,则W为Na元素;X 元素的原子最外层电子数为m,次外层电子数为n,Y元素的原子L层电子数为m+n,M层电子数m-n,则m+n=8,故X只能有2个电子层,则n=2,故m=8-2=6,可推知X为O元素;Y元素M层电子数=6-2=4,则Y为Si元素;Y元素与Z元素同主族,可推知Z为C元素;R元素原子与X元素原子的核外电子数之比为2:1,可知R原子核外电子数为16,则R为S元素,A、单质硅与电子碳均可以形成原子晶体,但碳60形成的是分子晶体,A不正确;B、氧化钠与过氧化钠中阴、阳离子的个数之比均为1:2,故B正确;C.酸性强弱顺序为:硫酸>碳酸>硅酸,故C正确;D、水分子之间存在氢键,其熔沸点高于硫化氢,故D错误,答案选AD。
考点:考查元素周期表的结构以及元素周期律的应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列说法中错误的是
| A.SO2、SO3都是极性分子 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
| A.E可能是一种金属元素 |
| B.在ECln中E与Cl之间形成共价键 |
| C.E位于元素周期表的IVA族 |
| D.E的一种氧化物为EO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是 ( )
| A.该元素单质是导体 |
| B.该元素单质在一定条件下能与盐酸反应 |
| C.该元素的最高化合价呈+5价 |
| D.该元素的氧化物的水合物显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
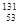 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中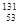 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关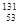 的叙述中错误的是
的叙述中错误的是
A 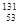 的化学性质与
的化学性质与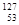 相同 B
相同 B 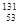 的原子序数为53
的原子序数为53
C 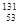 的原子核外电子数为78 D
的原子核外电子数为78 D 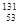 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质。而Z不能形成双原于分子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W < X < Y < Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于元素周期表的说法中正确的是
| A.元素周期表有8个主族 |
| B.ⅠA族的元素全部是金属元素 |
| C.元素周期表有7个周期 |
| D.短周期是指第1、2周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是
| | X | | Y | |
| | | | W | |
| | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com