
【题目】一种正投入生产的大型蓄电系统如图所示。放电前,被交换膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述不正确的是

A. 放电时,负极的电极反应式为2S22――2e-===S42-
B. 充电时,阳极的电极反应式为3Br--2e-===Br3-
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 充电时,M接电源负极,N接电源正极
【答案】D
【解析】
根据放电后Na2S2转化为Na2S4,S元素化合价升高,知Na2S2被氧化,说明N为负极;NaBr3转化为NaBr,Br元素化合价降低,知NaBr3被还原,说明M为正极,以此解答。
A. 根据放电后Na2S2转化为Na2S4,S元素化合价升高,知Na2S2被氧化,故负极的电极反应式为2S22――2e-===S42-,故A正确;
B. 充电时阳极发生氧化反应,NaBr转化为NaBr3,故阳极的电极反应式为3Br--2e-===Br3-,故B正确;
C. 放电时,阳离子向正极移动,故Na+经过离子交换膜,由b池移向a池,故C正确;
D. 充电时,原电池的负极接电源的负极,原电池的正极接电源的正极,故M接电源正极,N接电源负极,故D错误。
故选D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200KJ/mol,温度不同(T2>T1)其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某0.2L无土栽培用的营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得该营养液中部分离子的浓度柱状图如图甲所示:

(1)该营养液中K2SO4的物质的量浓度为____mol·L-1,含KCl的质量为____。
(2)该营养液中NH4Cl的物质的量为____。
(3)将该营养液加水稀释,稀释过程中NH![]() 的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=____,V2=___。
的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=____,V2=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在两个起始容积都为1 L的恒温密闭容器发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0。实验测得:v正=2v(H2)消耗=2v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=2v(H2)消耗=2v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2(HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的物质的量比为1∶3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=k正/k逆成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质均易溶于水,分别按下列条件配成溶液,其中物质的量浓度最大的是
A. 0.1 moL D物质溶于100 mL 2.5 mol·L-1的D溶液中
B. 9.2 g B物质(式量为46)溶于水配成100 mL溶液
C. 1.806×1023个C的分子溶于水配成100 mL溶液
D. 10 mL 5mol·L-1的A溶液加水配制成100 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,冶炼方法有火法和湿法。回答下列问题:
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga在元素周期表中的位置为___________。
(2)下列有关镓和镓的化合物的说法正确的是___________(填字母)。
A一定条件下,Ga可溶于盐酸和氢氧化钠溶液
B常温下,Ga可与水剧烈反应放出氢气
C.Ga2O3可由Ga(OH)3受热分解得到
D一定条件下,Ga2O3可与NaOH反应生成盐
Ⅱ工业上利用锌熔砂(主要含ZnO、ZnFe2O4,还含有少量 CaO, FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
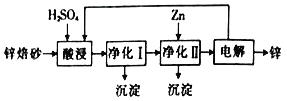
已知:Fe的活泼性强于Ni。
(3) ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式:___________。
(4)净化Ⅰ工操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,仅使Fe3+转化为Fe(OH)3沉淀,净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是______________________。
(5)净化Ⅱ中加入Zn的目的是______________________。
Ⅲ.(6)某化学课外小组拟用废旧电池锌皮(含杂质铁),结合如图所示信息,从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。
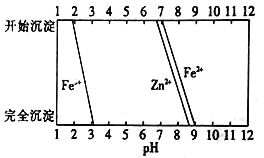
实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1的稀硫酸,加入___________(填字母,下同);
A.30%H2O2 B新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入___________;
A纯锌粉 B纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1的稀硫酸
③加热到60℃左右并不断搅拌;
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TMB由碳氢氮三种元素组成,其相对分子质量为240,是一种新型指纹检测的色原试剂,已在逐步取代强致癌物联苯胺和其他致癌性的联苯胺衍生物应用于临床化验法医检验刑事侦破及环境监测等领域。某研究小组欲利用燃烧法测定TMB的分子式(氮元素转化为N2)实验装置如图所示。回答下列问题:
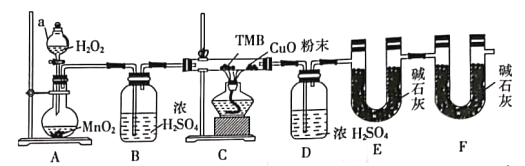
(1)实验装置两处用到装有碱石灰的干燥管,其中F处的目的是______________________。仪器a的名称是___________。
(2)将足量双氧水置于a中,圆底烧瓶中装入MnO2固体,按图连接好装置。
①A中发生反应的化学方程式为______________________。
②待B、D处导管口有均匀气泡时,再点燃C处酒精灯,原因是______________________。
(3)装置C中CuO粉末的作用为_________________________________。
(4)该实验___________(填“需要”或“不需要”)尾气处理,其原因是____________________。
(5)理想状态下,将4.80gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60g,E增加14.08g,则TMB的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素( )是一种治疗胆结石的药物,下列说法正确的是
)是一种治疗胆结石的药物,下列说法正确的是
A. 分子中的两个苯环都可以发生加成反应
B. 二氯代物超过两种
C. 1mol羟甲香豆素与氢气加成,最多需要5molH2
D. 所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液叙述错误的是
A. 某H2SO4溶液中c(OH-)/c(H+)=1.0×10-8,由水电离出的c(H+)=1×10-11mol·L-1
B. 将0.02mol·L-1盐酸与0.02mol·L-1Ba(OH)2溶液等体积混合后溶液pH约为12
C. 将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH一定大于7
D. 向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com