
����Ŀ��(1)�����Ͻ����κ��Է���������ԭ��Ӧ��������Ƴ�ԭ��أ������������з�Ӧ��Cu + 2Ag+ = 2Ag + Cu2+������һ����ѧ��أ�
�ٻ���������ԭ���װ��ͼ_____________________________ (�������������缫���Ϻ͵������Һ)
����������_____(����������������������������������ͬ)����������______
(2)����ȼ�ϵ�صĹ���ԭ����ͼ��ʾ��

�ٸõ�ع���ʱ��b��ͨ�������Ϊ______��c��ͨ�������Ϊ______��
�ڸõ�ظ����ĵ缫��ӦʽΪ��_____________________________��
�۹���һ��ʱ���3.2g������ȫ��Ӧ����CO2ʱ����_______������ת�ƣ�
���𰸡�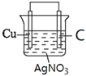 ���� ���� CH4 O2(����) CH4 - 8e- + 2H2O = CO2 + 8H+ 1.6NA
���� ���� CH4 O2(����) CH4 - 8e- + 2H2O = CO2 + 8H+ 1.6NA
��������
(1)���ݷ�Ӧ����ʽ֪��Cuʧ���ӣ����������������Һ�к��еõ��ӵ�Ag+��������������Һ���������Һ����������C���ݴ����ʵ��װ��ͼ�������ԭ���ԭ���������
(2)�ٸ����������ƶ�����֪���Ҳ�缫Ϊ���������缫Ϊ������
�ڸ�����ȼ��ʧ���ӷ���������Ӧ���������������õ��ӷ�����ԭ��Ӧ��
�۸��ݼ����ת�Ƶ���֮��Ĺ�ϵʽ���㡣
(1)��ԭ�����ʧ���ӵ����������������ݷ�Ӧ����ʽCu + 2Ag+ = 2Ag + Cu2+֪��Cu���������������Һ�к��еõ��ӵ�Ag+��������������Һ���������Һ����������C��������������Ϊ��������������װ��ͼΪ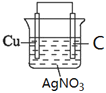 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
�ڸõ�ع���ʱ��������Ag+�õ������ɽ��������������ӣ�������ͭʧȥ���ӱ��ͭ���ӣ�������С���ʴ�Ϊ�����ӣ����٣�
(2)�ٸ��������ӵ��ƶ�����֪���Ҳ�缫Ϊ�����������������õ��ӣ����缫Ϊ������������ͨ��ȼ�ϼ��飬�ʴ�Ϊ��CH4��O2��
�ڸ����ϼ���ʧ���Ӻ�ˮ��Ӧ���ɶ�����̼�������ӣ��缫��ӦʽΪCH4 - 8e- + 2H2O = CO2 + 8H+���ʴ�Ϊ��CH4 - 8e- + 2H2O = CO2 + 8H+��
��3.2g��������ʵ���=![]() =0.2mol������CH4 - 8e- + 2H2O = CO2 + 8H+֪�� 3.2g������ȫ��Ӧ����CO2ʱ��ת�Ƶ��ӵ����ʵ���=0.2mol��8=1.6mol����ת�Ƶ��Ӹ���Ϊ1.6NA���ʴ�Ϊ��1.6NA��
=0.2mol������CH4 - 8e- + 2H2O = CO2 + 8H+֪�� 3.2g������ȫ��Ӧ����CO2ʱ��ת�Ƶ��ӵ����ʵ���=0.2mol��8=1.6mol����ת�Ƶ��Ӹ���Ϊ1.6NA���ʴ�Ϊ��1.6NA��


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2��5-���ȱ��������ںϳ�ҩ���ٵij��ݼ����������ز�ƽ�ȣ���ϳ�·�����£�

����˵�����������
A. �л���I����ԭ�Ӻ���ԭ�ӿ��ܲ�����
B. �л���I��һ����ȡ����������
C. �л���II��ֻ��һ��˫��
D. �л���III�ķ���ʽΪC7H5Cl2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���A�ĺ�����ͺ˴Ź�����������ͼ��ʾ������˵���д������
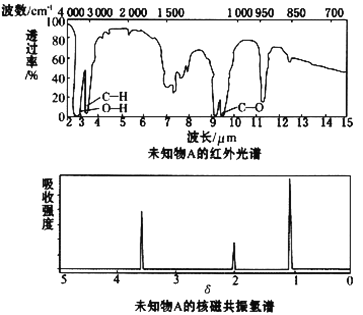
A. �ɺ������֪�����л��������ٺ������ֲ�ͬ�Ļ�ѧ��
B. �ɺ˴Ź�������֪�����л�������������ֲ�ͬ����ԭ���Ҹ�����Ϊ1��2��3
C. ������˴Ź�������֪������е���ԭ������
D. ��A�Ļ�ѧʽΪC2H6O������ṹ��ʽΪCH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У���Ӧ�������Լ����۶���ȷ�����߾��������ϵ����
ѡ�� | ʵ�� | ���� | ���� |
A | ����ɫֽ�����뵽������ˮ�� | ֽ����ɫ | ������Ư���� |
B | �������ữ��H2O2��Һ���뵽Fe(NO3)2��Һ�� | ��Һ���ɫ | H2O2�����Ա�Fe3+ǿ |
C | ������ǯ��סһС����ɰֽ��ϸ��ĥ���������ھƾ����ϼ��� | ���ۻ��ҵ������� | �����۵�ϵ� |
D | ��NaI��Һ���뵽AgCl����Һ�� | ������ɫ���� | Ksp(AgCl)>Ksp(AgI) |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�����CH3��CH=CH��C��C��CF3���ӽṹ����������ȷ���ǣ� ��
A��6��̼ԭ���п��ܶ���һ��ֱ����
B����5��̼ԭ�ӿ�����һ��ֱ����
C��6��̼ԭ��һ������ͬһƽ����
D��6��̼ԭ�Ӳ�������ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ���ˮ�Ҵ���������ʵ�鲽�����£�
I����������l00mLԲ����ƿ�м���l0gС����״����ʯ�Һͼ����������ƣ�����ע��50mL��ҵ�Ҵ�������1h��
���������ϣ�����ƿ��ȴ������ƿ�м��뼸����ʯ����Ϊ����װ�ã��ռ�78Cʱ����֣���Ϊ��ˮ�Ҵ�������������װ������ͼ���á���ʾ�ƾ��ƣ���

�ش��������⣺
��1��װ��b��������________ ��
��2����������ƿ�м�����ʯ�ҵķ���_____________
��3������NaOH������Ϊ�˳�ȥ��ҵ�Ҵ���������ȩ�������Ĺؼ���ӦΪCH3CHO��CH3CHO![]() CH3CH(OH)CH2CHO���÷�Ӧ�ķ�Ӧ����Ϊ____������1h��Ŀ����___ ��
CH3CH(OH)CH2CHO���÷�Ӧ�ķ�Ӧ����Ϊ____������1h��Ŀ����___ ��
��4������ʱ����____����____���ٵ�ȼ�ƾ��Ƣڽ�ͨ����ˮ������ţ������¶ȼ�ָʾΪ78������ʱ��β�ӹ��г���Һ�Σ���ȥ��ʼ������Һ�壬ԭ����____��
��5����ͬѧ���������Ϊ���ˣ���ش���˷�����ԭ�� ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����뾶�����������(����)
A. Ca2����K����Mg2����Al3��
B. F����Cl����Br����I-
C. Si��Al��Mg��Na
D. Ca2����K����Cl����S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�������й�������ȷ����(����)
A. 14 g��ϩ�ͱ�ϩ��������е���ԭ����Ϊ2NA
B. 1 mol N2��4 mol H2��Ӧ���ɵ�NH3������Ϊ2NA
C. 1 mol Fe���ڹ������ᣬ����ת����Ϊ2NA
D. ��״���£�2.24 L CCl4���еĹ��ۼ���Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ��ΪNH3��H2O��������Բ����ð�ˮ��FeCl3��Һ��Ӧ��ȡFe(OH)3
B. ��FeI2��Һ��ͨ������Cl2���ٵμ�����CCl4�������ã��²�Һ��Ϊ��ɫ
C. ��һ���������Ũ�����м������������ۣ����ɵ������ܱ��ռ���Һ��ȫ����
D. ��SO2����ͨ����ˮ���������Ƿ���SO42-���ɣ�������Һ�еμ�Ba(NO3) 2��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com