
| A. | 石灰石与硝酸反应;石灰石与盐酸 | |
| B. | BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 | |
| C. | Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 | |
| D. | 氢氧化钠与盐酸,;氢氧化钠与碳酸 |
分析 A.反应的实质都是碳酸钙与氢离子反应生成钙离子、水;
B.Ba(OH)2溶液与H2SO4溶液,除了钡离子与硫酸根离子反应外,氢离子与氢氧根离子也会反应生成水;
C.碳酸钙为难溶物,保留化学式;
D.碳酸为弱电解质,应保留化学式.
解答 解:A.二者反应的实质都是碳酸钙与氢离子反应生成钙离子、水,反应的离子方程式都是:2H++CaCO3=Ca2++H2O+CO2↑,故A正确;
B.前者离子方程式为:Ba2++SO42-=BaSO4↓,后者离子方程式为:2OH-+2H++Ba2++SO42-=BaSO4↓+2H2O,二者不能用同一个离子方程式表示,故B错误;
C.前者离子方程式为:2H++CO32-=H2O+CO2↑,后者离子方程式为:2H++CaCO3=Ca2++H2O+CO2↑,二者不能用同一个离子方程式表示,故C错误;
D.前者离子方程式为:H++OH-=H2O,后者离子方程式为:H2CO3+2OH-=2H2O+CO32-,二者不能用同一个离子方程式表示,二者不能用同一个离子方程式表示,故D错误;
故选A.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- | B. | Al3+ | C. | Fe3+ | D. | NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征是丁达尔效应 | |
| B. | 胶体的介稳性在生产和生活中应用比较普遍,如颜料、墨水的制造,洗涤剂、喷雾剂的应用等 | |
| C. | 非金属氧化物一定是酸性氧化物 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液、胶体、浊液的本质区别是分散质粒子直径的大小 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
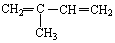 与Br2按物质的量之比1:1发生1,4加成反应方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br
与Br2按物质的量之比1:1发生1,4加成反应方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s);△H=-26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石)△H=1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Cu2+、Cl-、ClO-可以大量共存 | |
| B. | 和FeCl3溶液反应的离子方程式:HS-+2Fe3+═S↓+2Fe2++H+ | |
| C. | 和过量NaOH溶液反应的离子方程式:HS-+OH-═S2-+H2O | |
| D. | 向该溶液中通入过量的SO2,无沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com